مانیتورینگ تمرین به واسطه ترکیبات نیتروژنی غیر پروتئینی
نویسندگان: علیرضا نیک نام (دکتری فیزیولوژی ورزشی) Alireza73.Niknam@gmial.com
چکیده
این مقاله مروری برگرفته از مطالعاتی است که به نقش ترکیبات نیتروژنی غیر پروتئینی در مانیتورینگ و تنظیم پاسخ های سازشی به تمرین ورزشی پرداخته اند. نیتروژن یکی از عناصر بسیار مهم و پر کاربرد در زندگی و محیط اطراف ما است و نقش مهمی در حفظ سلامت بدن موجودات زنده از جمله انسان ایفا می کند. این عنصر به وفور در محیط اطراف ما یافت می شود و حدود ۸۰ درصد جو زمین را تشکیل داده است و با هر نفسی که می کشیم وارد بدن ما می شود. با این وجود بدن انسان قادر به استفاده از نیتروژنی که به طور مستقیم از هوا یا خاک دریافت می کند نمی باشد و نیاز است این عنصر از طریق گیاهان سبز و میکروب ها به شکل قابل استفاده برای انسان تبدیل شود. نیتروژن نقش مهمی در عملکرد سیستم های مختلف بدن ایفا می کند که یکی از مهم ترین آن ها تولید پروتئین است. بدن ما برای ساخت پروتئین در عضلات، پوست، خون، مو، ناخن ها و DNA به نیتروژن نیاز دارد و از آن در اسیدهای آمینه برای ساخت سایر اسید آمینه هایی که برای سنتز پروتئین انسانی استفاده می شوند بهره می برد. اسیدهای نوکلئیک DNA که ژن ما را تشکیل می دهند و RNA که در سنتز پروتئین دخیل می باشند نیز حاوی نیتروژن می باشند. نیتروژن در عملکرد هورمون ها، عملکرد مغز و سیستم ایمنی بدن نیز نقش مهمی داشته و رشد طبیعی بدن، جایگزینی سلول ها و ترمیم بافت ها همگی برای تولید سلول های جدید به نیتروژن نیاز دارند. بدن از نیتروژن برای ساخت ترکیبات غیر پروتئینی مانند ماده “هِم” در هموگلوبین که اکسیژن را به گلبول های قرمز خون منتقل می کند نیز استفاده می کند. به طور خلاصه باید اذعان داشت نیتروژن یکی از ۴ عنصر اصلی تشکیل دهنده بدن یعنی هیدروژن، کربن، نیتروژن و اکسیژن است. با وجود این ترکیبات نیتروژنی بدن به طور کلی به ۲ بخش قابل تقسیم هستند: ۱- ترکیبات نیتروژنی پروتئینی و ۲- ترکیبات نیتروژنی غیر پروتئینی. مهمترین ترکیبات نیتروژنی غیر پروتئینی عبارتند از: اوره، کراتین، کراتینین، اسید اوریک،گلوتاتیون، آمونیاک، آمینو اسیدها، اورنیتین، سیترولین، نیتریک اکساید و گونه های واکنشی نیتروژنی (RNS). که در این مطالعه به معرفی نقش هر یک از آن ها در مانیتورینگ و تنظیم پاسخ های سازشی به تمرین خواهیم پرداخت.
مقدمه
ترکیبات نیتروژنی غیر پروتئینی (NPN) عمدتاً به صورت میانجی های سوخت و سازی، فرآورده های زائد سوخت و سازی که باید از بدن حذف شوند و یا ملکول های پیام رسان در تنظیم پاسخ های سازشی بدن نقش دارند. هر نوع ترکیب غیر پروتئینی که حاوی اتم نیتروژن باشد را می توان به عنوان NPN تلقی کرد. با وجود این معروف ترین و مهم ترین NPN ها عبارتند از نوکلئیک اسید ها، نوکلئوتید ها، نوکلئوزید ها، اوره، کراتین، کراتینین، اسید اوریک، گلوتاتیون، آمونیاک، آمینو اسید ها، اورنیتین، سیترولین، نیتریک اکساید و گونه های واکنشی نیتروژنی (RNS). تغییرات محیط داخلی بدن می تواند بر مقادیر انواع NPN ها تاثیر گذارد. برای مثال شرایط های بیماری نظیر نارسایی کلیه، نارسایی احتقانی قلب، خونریزی های گوناگون داخلی، انسداد دستگاه ادراری، بیماری های کبدی و حتی تغییرات توده عضلانی می تواند بر مقادیر NPN خون و ادرار نظیر اوره (محصول نهایی کاتابولیسم پروتئین ها در بدن)، اسید وریک (محصول نهایی متبولیسم پورین ها) و کراتینین (ماده شیمیایی دفعی ناشی از متابولیسم ) تاثیر گذارد (۱). به علاوه، اطلاعات نشان می دهد، الگوهای تغذیه ای و فعالیت بدنی نیز بر انواع NPN ها در سطح سلولی و سیستمیک تاثیر دارد. برای مثال مطالعات نشان داده اند، خستگی ناشی از فعالیت ورزشی با سطوح افزایش یافته آمونیاک در ارتباط است (۱, ۲). در واقع اظهار شده است هنگام فعالیت های ورزشی طولانی مدت با شدت متوسط به دلیل کاهش ذخایر منابع گلیکوژنی در سطح سلول های عضلانی، نوسازی ATP نمی تواند با سرعت مناسب انجام شود که در نتیجه باعث افزایش مقادیر اینوزین مونوفسفات (IMP) و آمونیاک در سطح سلولی می شود. با وجود این مطالعه روسیپ و همکارانش ۲۰۱۸ نشان داد، مصرف کربوهیدرات هنگام فعالیت ورزشی یکنواخت با شدت متوسط بر تولید آمونیاک و اوره هنگام فعالیت ورزشی تاثیر معناداری ندارد (۱). بنابراین هنوز جمع بندی یافته های درباره تنظیم پاسخ های آمونیاک و اوره به فعالیت ورزشی و میانجی های تغذیه ای جای کار دارد. علاوه بر آمونیاک و اوره، کراتینین نیز یکی دیگر از NPN های مورد توجه است. با این حال شواهد نشان می دهد مقادیر کراتینین اگرچه در ورزشکاران با افراد عادی جامعه تفاوت داردف اما از سطوح مرجع ذکر شده فراتر نمی رود. به علاوه به نظر می رسد مقادیر کراتینین بین انواع ورزشکاران در رشته های ورزشی گوناگون به عنوان تابعی از ویژگی های پیکرسنجی و توده عضلانی متفاوت است (۳, ۴). سیترولین، نیتریک اکساید و اورنیتین هر سه در یک ارتباط نزدیک با یکدیگر به عنوان NPN های میانجی در بهبود عملکرد ورزشی و تنظیم پاسخ های سازشی به تمرین ورزشی نقش دارند. سیترولین و اورنیتین به عنوان میانجی های اصلی چرخه اوره در کبد می توانند بر مقادیر آمونیاک و اوره خون نیز نقش داشته باشند (۵). در این مطالعه، تمرکز اصلی ما بر نقش بالقوه آمونیاک، اوره و کراتینین در پایش تمرینات ورزشی است، به علاوه با یک نگاه دقیق نقش سیترولین را در ارتباط با سایر NPN ها و نیز فعالیت ورزشی بررسی کرده ایم.
نقش آمونیاک و اوره در مانیتورینگ فعالیت ورزشی کوتاه مدت
اوره یک ترکیب آلی با فرمول شیمیایی (CO(NH₂)₂) می باشد. این مولکول دارای دو گروه آمین باقیمانده است، که به یک گروه کربونیل که گروهی عملکردی است، اتصال می یابد. بیش از ۹۹ درصد سنتز اوره در کبد رخ می دهد. از نظر تغذیه ای منبع اصلی آن پروتئین رژیم غذایی است. در روده، پروتئین به پپتیدها و اسیدهای آمینه تبدیل می شود و بیش از ۹۰ درصد از آن جذب می شود و به کبد حمل می شود. در سلول های هیپوتوسیت، اسید آمینه ها، آمین زدایی شده و انتقال داده می شوند.نیتروژن اضافی به چرخه اوره وارد می شود و با اوره ترکیب می شود. پروتئین فرار جذب شده توسط روده کوچک، به علاوه اوره بازیافت شده، توسط فلور روده عمدتاً در روده بزرگ به آمونیاک تبدیل می شود. گردش آمونیاک از طریق گردش خون باب، به کبد برای ورود به چرخه اوره است. با وجود این، مطالعات نشان می دهد هنگام فعالیت ورزشی شدید یا متوسط طولانی مدت غلظت آمونیاک افزایش می یابد. تشکیل آمونیاک هنگام فعالیت ورزشی احتمالاً ریشه در کاهش ذخایر سوختی سلول به ویژه گلیکوژن دارد که سرعت تشکیل ATP را محدود کرده و در نتیجه باعث افزایش مقادیر اینوزین مونوفسفات و آمونیاک می شود (۱, ۲). منابع اصلی تولید آمونیاک هنگام فعالیت ورزشی واکنش آدنوزین مونوفسفات دِآمیناز (AMP-D) و کاتابولیسم اسید های آمینه شاخه دار (BCAA) ذکر شده است. هنگام فعالیت های ورزشی استقامتی طولانی مدت با شدت متوسط به نظر می رسد کاهش ذخایر گلیکوژنی عضلات در حال فعالیت باعث تجمع ADP و در نتیجه ناتوانی سلول در بازسازی ATP با سرعت مناسب می شود (۱, ۲). این منابع کاهش یافته گلیکوژن نمی تواند نوسازی ATP را حفظ کند و در نتیجه باعث تجمع اینوزین مونوفسفات و آمونیاک می شود.
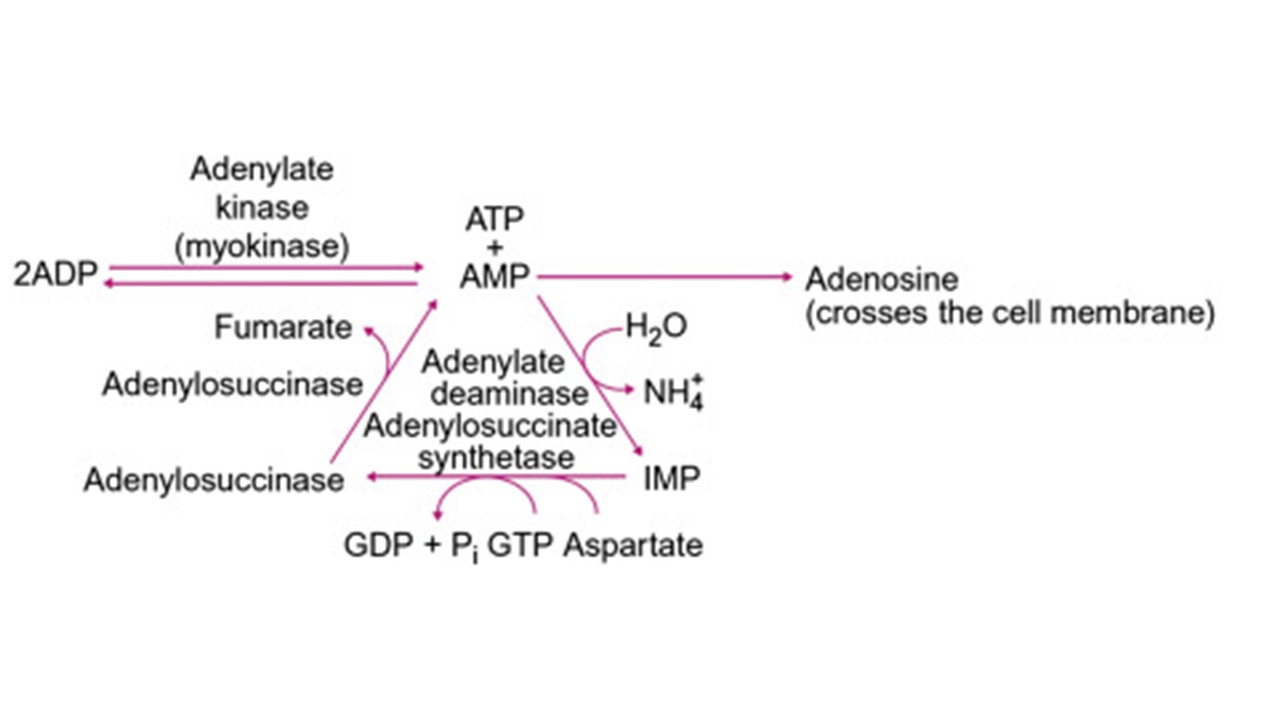
شکل ۱. متابولیسم آدنوزین منو فسفات (AMP) توسط آدنیلات دِآمیناز (AMP-D) و بازتولید مجدد AMP. همانطور که در شکل نشان داده شده است در اثر واکنش آدنیلات دِآمیناز آمونیاک تولید می شود که می تواند سرنوشت های گوناگونی را در سطح سلولی یا برون سلولی داشته باشد.
تأثیر محتوای کم گلیکوژن بر متابولیسم آمونیاک در حال حاضر نامشخص است زیرا یک مطالعه گزارش کرده است تولید آمونیاک عضله در این شرایط افزایش یافت، در حالی که مطالعه دیگری هیچ تغییری مشاهده نکرده است. برخی مطالعات در دوچرخه سواران ورزیده تأثیر مصرف کربوهیدرات را همراه با دستکاری گلیکوژن عضله بر تولید آمونیاک را هنگام ۲ ساعت فعالیت ورزشی دوچرخه سواری مطالعه کردند. با وجود این، نشان داده شد در ۲۰ دقیقه ابتدایی فعالیت ورزشی هنگامی که شدت ورزش یکسان بود، غلظت آمونیاک پلاسما در افرادی که ذخایر کربوهیدراتی آن ها تخلیه شد افزایش یافت (۱). غلظت بالاتر آمونیاک پلاسما به افزایش تولید آمونیاک عضلانی ناشی از کاتابولیسم اسیدهای آمینه نسبت داده شد. به علاوه این مطالعات اظهار کرده اند، خستگی در فعالیت های ورزشی با شدت متوسط طولانی مدت با کاهش ذخایر گلیکوژنی ارتباط دارد که این به نوبه خود با افزایش سطوح آمونیاک همراه است (۱). هنگام فعالیت ورزشی شدید کوتاه مدت نیز آمونیاک تولید شده معمولاً با افزایش خستگی همراه است. به نظر می رسد عمده آمونیاک تولیدی هنگام فعالیت ورزشی شدید ریشه در واکنش AMP دِآمیناز دارد و از محل دِآمیناسیون AMP تامین می شود. در واقع اظهار شده است هنگامی که استفاده از ATP هنگام فعالیت ورزشی با باز سنتز آن جفت نشود، کاهش ذخایر ATP رخ می دهد که باعث دِآمیناسیون غیر قابل برگشت AMP و تشکیل آمونیاک و اینوزین مونوفسفات می شود (۱, ۲). این رخداد با افزایش غلظت آمونیاک پلاسما همراه است. بنابراین می توان از آمونیاک به عنوان یک شاخص مانیتورینگ در فعالیت های ورزشی برای از دست رفتن ATP و استرس های سوخت و سازی ایجاد شده استفاده کرد. همچنین، افزایش مقادیر پلاسمایی آمونیاک می تواند به عنوان یک نشانگر استرس سوخت و سازی که بر انقباض عضلانی تاثیر دارد و با خستگی همراه است پایش شود. روسیپ و همکارانش (۲۰۱۸) در مطالعه تاثیر فعالیت ورزشی بر غلظت های پلاسمایی آمونیاک و اوره پس از مصرف نوشیدنی های الکترولیتی کربوهیدراتی را بررسی کردند (۱). یافته های این مطالعه نشان داد، منبع غالب تولید آمونیاک هنگام فعالیت ورزشی، در درجه اول به دلیل از بین رفتن AMP عضلانی توسط واکنش آدنیلات دِآمیناز است.
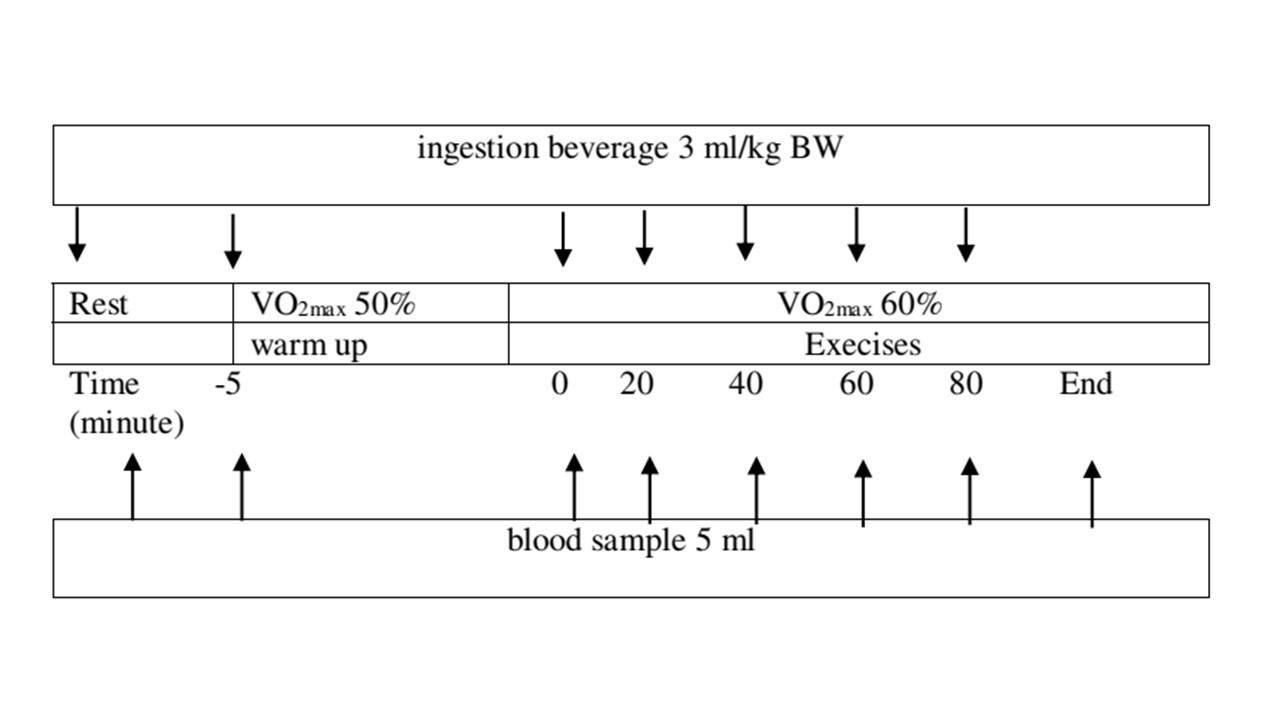
شکل ۲. طرح مطالعاتی روسیپ و همکارانش ۲۰۱۸، BW: وزن بدن، VO2max: حداکثر اکسیژن مصرفی، ml: میلی لیتر، در این مطالعه غلظت آمونیاک و اوره خون انسان در نمونه های گرفته شده به صورت متوالی به فاصله ۲۰ دقیقه در طول آزمون رمپی تداومی تا خستگی روی دوچرخه کارسنج بررسی شد.
در این مطالعه مطابق شکل ۲، هر آزمودنی به صورت دو سوکور و ترتیب تصادفی با یک فاصله زمانی ۲ هفته ای تحت سه شرایط گوناگون (مصرف محلول پرکربوهیدرات (۱۲%)، مصرف محلول با کربوهیدرات متوسط (۶%)، و پلاسیبو) هنگام فعالیت ورزشی روی چرخ کارسنج مورد آزمایش قرار گرفتند. در هر نوبت، آزمودنی ها بعد از ۱۰ تا ۱۲ ساعت ناشتایی به آزمایشگاه مراجعه و یک کاتتر ۱۸ در عروق سطحی ساعد آن ها کار گذاشته شد. ضربان قلب نیز با استفاده از حسگر ضربان قلب هنگام تمرین پایش شد. ۵ دقیقه پیش از شروع دوچرخه سواری (گرم کردن)، آزمودنی ها هر بار ۳ میلی لیتر/کیلوگرم وزن بدن محلول کربوهیدراتی یا پلاسیبو را مصرف می کردند. نمونه های خونی نیز هر بار، در شرایط استراحتی و هر ۲۰ دقیقه تا لحظه واماندگی در فعالیت ورزشی اخذ شد (جدا سازی پلاسما با سانتریفیوژ در دمای ۴ درجه سلسیوس انجام و سپس پلاسما در دمای ۷۰- درجه سلسیوس نگهداری و برای سنجش مقادیر آمونیاک و اوره مورد استفاده قرار گرفت).
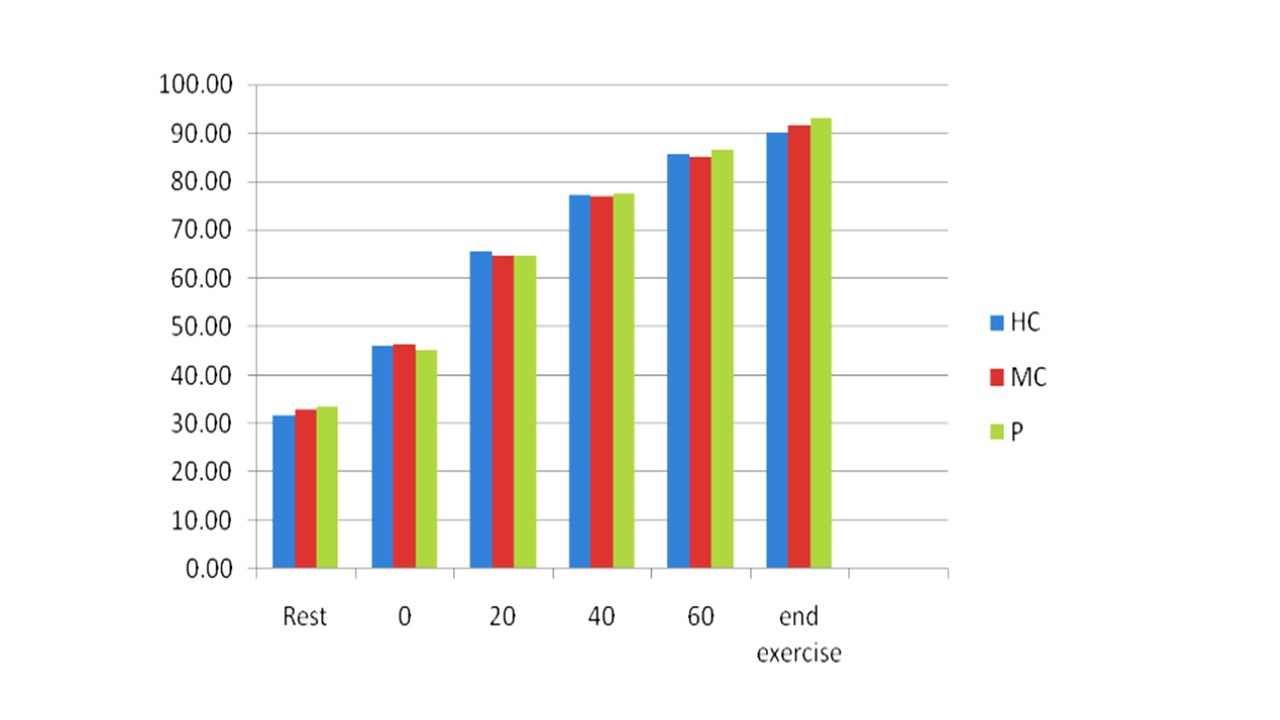
شکل ۳. تغییرات مقادیر پلاسمایی آمونیاک از حالت استراحت تا لحظه درماندگی، شدت فعالیت ورزشی ۶۰ درصد حداکثر اکسیژن مصرفی، برگرفته از بوسیپ و همکارانش (۲۰۱۸). واحد اندازه گیری آمونیاک میکرومول بر لیتر بوده است.HC: نوشیدنی پر کربوهیدرات (۱۲%)، MC: نوشیدنی با کربوهیدرات متوسط (۶%)، P: پلاسیبو (آب)
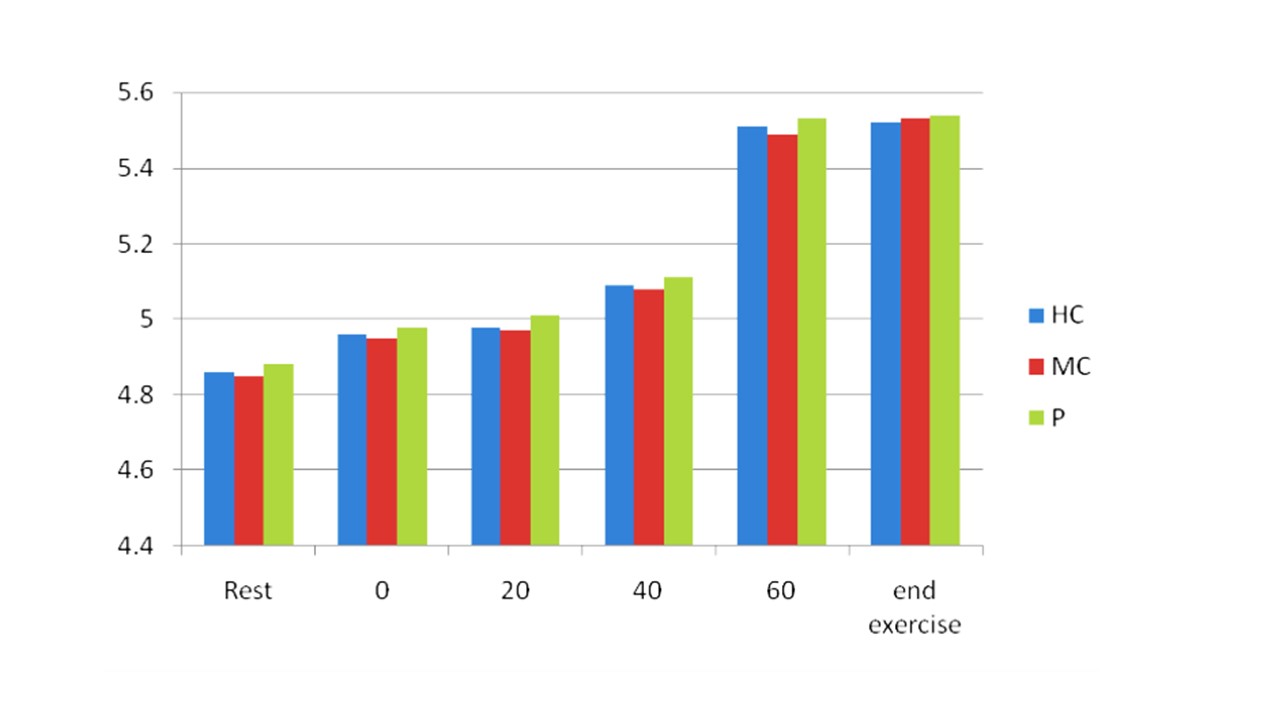
شکل ۴. تغییرات مقادیر پلاسمایی اوره از حالت استراحت تا لحظه درماندگی، شدت فعالیت ورزشی ۶۰ درصد حداکثر اکسیژن مصرفی، برگرفته از بوسیپ و همکارانش (۲۰۱۸). واحد اندازه گیری اوره میکرومول بر لیتر بوده است.HC: نوشیدنی پر کربوهیدرات (۱۲%)، MC: نوشیدنی با کربوهیدرات متوسط (۶%)، P: پلاسیبو (آب)
در این مطالعه معلوم شد، آمونیاک پلاسما در فعالیت ورزشی طولانی مدت با شدت زیر بیشینه افزایش می یابد (شکل ۳). یکی از منابع آمونیاک پلاسمای خون، فعالیت دِآمینه شدن AMP در سلول های عضلانی است. همسو با این یافته ها، بروبرگ و ساهلین، ۱۹۸۹ پیشنهاد کردند که تکه های آدنین نوکلئوتید ممکن است به دلیل گلیکوژن کم در عضلات باشد. همچنین، برونز و همکاران (۱۹۹۰) نیز مقادیر زیاد آمونیاک در عضله را با خستگی عضلات هنگام فعالیت ورزشی طولانی مدت مرتبط دانسته اند. هر چند سطوح زیاد آمونیاک ثانویه به کاهش سطح گلیکوژن عضلانی بود، اما معلوم نیست افزایش آمونیاک دلیل خستگی است یا میزان کم کربوهیدرات باعث تسریع در خستگی می شود. در مطالعه بوسیپ و همکارانش (۲۰۱۸) نیز، افزایش سطوح آمونیاک پلاسما در سه نوع نوشیدنی مصرف شده تقریباً یکسان بود، هر چند غلظت پلاسمایی آمونیاک در شرایطی که نوشیدنی های کربوهیدراتی ۱۲ درصد مصرف شدند کمی پایین تر بود. نتایج بوسیپ و همکارانش نشان داد، افزایش آمونیاک پلاسمایی ناشی از دآمینه شدن AMP ممکن است بیشتر به اکسیژن رسانی وابسته باشد. در واقع در حالت عادی غلظت آمونیاک ۴۷-۶۵ میکرومولار در لیتراست، که هنگام فعالیت ورزشی می تواند تا ۲۰ برابر افزایش یابد. در مطالعه بابیج و همکاران (۱۹۸۳) نشان داده شد در حالت استراحت سطح آمونیاک خون شریانی تا ۵۰ درصد برخاسته از عضلات اسکلتی است، علاوه بر این بابیج برآورد کرد، فقط ۲۸ درصد از کل آمونیاک تولید شده توسط دآمینه شده نوکلئوتیدهای آدنیلاتی است که به دلیل تجمع آمونیاک در خون و در عضلات آمونیاک به عنوان یک بافر برای سنتز آلانین ، گلوتامیک و گلوتامین مورد استفاده قرار می گیرد. فعالیت های چرخه گلوکز-آلانین، نیز در هنگام فعالیت ورزشی افزایش می یابد. آلفا کتوگلوتارات و پیروات در عضله اسکلتی یک پیش ماده هستند که هنگام فعالیت ورزشی افزایش می یابند و میل دارند که آمونیاک را به عنوان یک بافر دریافت کنند. افزایش آمونیاک خون هماهنگ با افزودن شدت فعالیت ورزشی، احتمالاً یک ارتباط دو سویه با تغییرات در سنتز آمونیاک از راه گلوتامات، گلوتامین و آلانین باشد (۱). تولید گلوتامین و آلانین در عضلات اسکلتی هنگام تشکیل تحت تأثیر PH عضلانی است. با وجود این، میزان مصرف آلانین و گلوتامین توسط عضله بیشتر از مصرف اسید لاکتیک است که به اسیدهای آمینه کمک می کند که توسط PH کنترل شوند. زمان ریکاوری شدت فعالیت ورزشی به دنبال کاهش آمونیاک و اسید لاکتیک خون کاهش می یابد و منجر به تسریع ریکاوری می شود. این وضعیت نشان می دهد بین بارهای کاری و سطوح افزایش یافته آمونیاک و اسید لاکتیک خون ارتباط معنا داری وجود دارد. این افزایش یک رابطه دوسویه بین تولید سوبستراها در عضله، انتشار به درون خون و تغییرات سوبسترا از راه چند مسیر متابولیکی است. به علاوه یافته های مطالعه بوسیپ و همکارانش (۲۰۱۸) درباره اوره نشان داد، سطوح پلاسمایی اوره پس ازمصرف سه نوع نوشیدنی (پرکربوهیدرات، کم کربوهیدرات و پلاسیبو) افزایش می یابد (۱). نتایجی همسو در مطالعات قبلی توسط فالوفید و ویلیام نیز یافت شده است. همچنین افزایش اوره پلاسما هنگام فعالیت ورزشی مشاهده شد که نشانه سوخت و ساز پروتئین است. بنابراین، افزایش اوره پلاسما می تواند خستگی هنگام فعالیت ورزشی را برآورد کند. بنابراین این یافته ها نشان می دهد، مصرف کربوهیدرات ها بر تغییرات سطوح اوره هنگام فعالیت ورزشی تاثیری ندارد. بنابراین تولید آمونیاک هنگام فعالیت ورزشی نشانگری از شدت فعالیت ورزشی و خستگی عضلانی است (۱, ۲). فعالیت ورزشی یکنواخت می تواند ظرفیت عضلات را افزایش دهد و تغییرات در سطوح آمونیاک با افزایش سنتز گلوتامین همراه است. متابولیسم آمونیاک و اسید آمینه در سیستم عصبی محیطی و مرکزی و یکپارچه سازی فعالیت بدنی، مهم است که این افزایش ممکن است تحت تأثیر مسیرهای متابولیکی هنگام فعالیت ورزشی باشد. در مطالعه بوسیپ و همکارانش، آمونیاک پلاسما و اوره پس از مصرف نوشیدنی های پرکربوهیدرات، کم کربوهیدرات و پلاسیبو افزایش یافتند اما بین این شرایط ها تفاوت های معناداری مشاهده نشد که نشان می دهد بین مصرف کربوهیدرات ها و متابولیسم نوکلئوتیدهای سلولی و پروتئین ها رابطه معناداری وجود ندارد. در مطالعه روسیپ و همکارانش، سطح اسید لاکتیک خون به دلیل شدت فعالیت ورزشی (زیر بیشینه، ۶۰ درصد VO2max) تا چند دقیقه پایانی فعالیت ورزشی به اوج نرسید و با سطوح آمونیاک خون که در پایان تمرین به حداکثر رسید و با قطع فعالیت ورزشی به آهستگی کاهش یافت، متفاوت بود. بنابراین، می توان گفت افزایش سطوح آمونیاک خون با نقطه پایانی خستگی برابر است. با توجه به این یافته ها به نظر می رسد، در مقایسه با اسید لاکتیک استفاده از معیارهای NPN نظیر آمونیاک می تواند با شدت فعالیت ورزشی تا خستگی ارتباط بهتری داشته باشد (۱, ۲).
نقش کراتین و کراتینین در مانیتورینگ ورزشکاران
کراتینین (Crn) یک ترکیب نیتروژنی غیر پروتئینی (NPN) است که محصول تجزیه کراتین فسفات در عضلات اسکلتی می باشد (۳). در واقع کراتینین به صورت غیرآنزیمی از کراتین مشتق می شود (۴). نرخ بازگردش کراتین در مردان سالم ثابت است و ۱.۶ درصد از کل مخزن کراتین در روز را نشان می دهد. بنابراین، با توجه به توده عضلانی کل، که مهمترین عامل تعیین کننده اندازه مخزن کراتین است، مقدار کراتینین تولید شده و آزاد شده از یک فرد قابل محاسبه است، زیرا عضلات اسکلتی حاوی حدود ۹۸ درصد مقدار کل کراتین بدن است (۴). واضح است که غلظت کراتینین در خون، که به عنوان پارامتر میزان فیلتراسیون گلومرولی (GFR) استفاده می شود، می تواند تحت تأثیر توده بدن، رژیم غذایی (محتوای گوشت در رژیم غذایی) و روش های تجزیه و تحلیل باشد. روش Jaffe که معمولاً برای اندازه گیری کراتینین استفاده می شود، ساده و ارزان است و به راحتی با سیستم های خودکار سازگار می شود (۴). با این حال ، این روش توسط مولکول هایی غیر از کراتینین تا ۲۰ درصد از مقدار کل تاثیر می پذیرد. به همین دلیل، روش های آنزیمی و اخیراً کالیبراسیون همه روش ها در برابر طیف سنجی جرمی رقیق شده کروماتوگرافی گازی – ایزوتوپ توصیه می شود. گزارش شده است در اثر عملکرد پایدار کلیوی و حالت یکنواخت، کراتینین وابسته به مقادیر مطلق توده عضلانی، معمولاً با سرعت نسبتاً ثابتی توسط بدن تولید می شود. کراتینین معمولاً توسط تصفیه گلومرولی از خون حذف می شود (و به میزان کمتری در توبول های پروگزیمال کلیه دفع می شود) (۳). چون بازجذب لوله ای کراتینین ناچیز است، از کلیرانس کلیوی آن اغلب برای برآورد میزان تصفیه گلومرولی استفاده می شود. در عملکرد پایدار کلیوی، در صورت کنترل دقیق متغیرهای غیر وابسته به توده عضلانی (مانند فیلتراسیون کلیوی یا مصرف گوشت)، غلظت سرمی یا پلاسمائی کراتینین سرم می تواند، انعکاسی از توده عضلات اسکلتی بدن باشد (۳). در افرادی که عملکرد کلیوی و دفع ادرار پایداری دارند، کراتینین ادرار ۲۴ ساعته معمولاً یک مقدار ثابت بر پایه توده عضلات اسکلتی است (۳). در اوایل دهه ۱۹۸۰، مطالعه ای روی ۲۴ مرد سالم نشان داد کراتینین کل پلاسما با دفع کراتینین ادرار و با وزن بدن، آب کل بدن و توده خالص بدنی (LBM) برآورد شده با معیارهای پیکرسنجی ارتباط قوی دارد. مطالعه دیگری نیز روی ۲۷ بیمار همودیالیزی بزرگسال نشان داد LBM به دست آمده از تجزیه و تحلیل امپدانس بیوالکتریک (BIA) و جذب سنجی دوگانه اشعه ایکس (DEXA) با کراتینین سرم ارتباط خوبی داشت (۳). علاوه بر این، مطالعه دیگری نیز از این نتایج پشتیبانی کرد که نشان دهنده ارتباط قوی بین سطوح کراتینین سرم و توده عضلانی اسکلتی در بیماران دیالیزی بوده است. به علاوه مطالعه ای نشان داد، دفع کم کراتینین، به عنوان مقیاس غیر مستقیم توده عضلانی کم، با افزایش بروز حوادث قلبی عروقی و مرگ و میر ناشی از آن، مستقل از مقاومت به انسولین، در ارتباط است. مقادیر مرجع کراتینین ورزشکاران با مقادیری که برای جمعیت عمومی استفاده می شود ممکن است تفاوت داشته باشد (۶). در واقع معمولاً تصور می شود ورزشکاران از نظر جسمانی عادی و سالم هستند، اما حجم زیاد بارهای کاری تمرین و استرس روانی-جسمانی به ناشی از مسابقات می تواند باعث تغییر در هوموستاز شود و مقادیر بیوشیمیایی و هماتولوژیکی به ظاهر پاتولوژیکی ایجاد کند (۴). با کمال تعجب، مطالعات و گزارش های کمی به مقادیر کراتینین سرم در ورزشکاران وجود دارد. به علاوه، گزارش های کمی درباره کاربردهای معادله، بر اساس مقادیر کراتینین، در ورزشکاران وجود دارد. استفاده از این معادلات در حال حاضر توسط انجمن های پزشکی بین المللی توصیه شده است، هر چند استفاده از آن ها در افرادی که با مقادیر تصفیه گلومرولی طبیعی شناسایی می شوند هنوز مورد بحث است (۴).
دامنه مرجع کراتینین در جمعیت عمومی بین ۶۲ تا ۱۱۵ میکرومول در لیتر (۰.۷-۱.۳ میلی گرم در دسی لیتر) برای مردان بالغ است. با وجود این در مطالعه ای بین ورزشکاران نخبه کشور ایتالیا (۲۲۰ ورزشکار مرد حرفه ای بین المللی در ۸ رشته ورزشی مختلف با دامنه سنی ۱۷ تا ۳۷ سال) نشان داد، به طور کلی، کراتینین تحت تأثیر تمرین و فصل مسابقات قرار نمی گیرد، حتی در هنگام تلاش های تمرینی شدید (۶). اطلاعات این پژوهش نشان داد مقادیر کراتینین در ورزشکاران نخبه به طور کلی بیشتر از گروه کنترل (غیر ورزشکار) است، همانطور که انتظار می رود می تواند به دلیل توده عضلانی بالاتر باشد. ورزشکاران این مطالعه در ۸ رشته ورزشی گوناگون با ویژگی های متفاوت متابولیسم هوازی / بی هوازی، بار تمرین و دوره های مسابقات و تمرین متفاوت مشارکت داشتند. پژوهشگران استفاده از حدود مرجع بر اساس جمعیت عمومی را در پزشکی ورزشی توصیه نمی کنند زیرا می تواند باعث سوءتفسیر داده ها شود و در نتیجه مداخلات غیر ضروری را به دنبال داشته باشد (۶). همانطور که در شکل ۴ مشاهده می کنید، نزدیک به ۷۰ درصد ورزشکاران مقادیر کراتینین بیشتر از ۸۸ میکرومول بر لیتر داشتند در حالی که نزدیک به ۵۰ درصد افراد غیرورزشکار مقادیر کراتینین سرم بیشتر از این مقدار را نشان داده اند. بر عکس مقادیر کراتینین سرم کمتر از ۸۸ میکرومول بر لیتر تنها ۳۰ درصد از جامعه ورزشکاران را شامل شد در حالی که حدود ۵۰ درصد از افراد غیر ورزشکار در این توزیع جای گرفتند (۶). بنابراین می توان گفت مقادیر استراحتی کراتنینین در ورزشکاران بالاتر از افراد غیر ورزشکار است اما فراتر از آستانه بالینی خطرناک نمی رود. این افزایش در سطوح کراتینین احتمالاً به دلیل توده عضلانی بیشتر در ورزشکاران نخبه است. توصیه شده است که برای هر ورزشکاری، ارزیابی های متوالی کراتینین کنترل شود، یکی از مقادیر تعیین شده قبل از شروع تمرینات و مسابقات به عنوان مقدار پایه استفاده شود (۶).
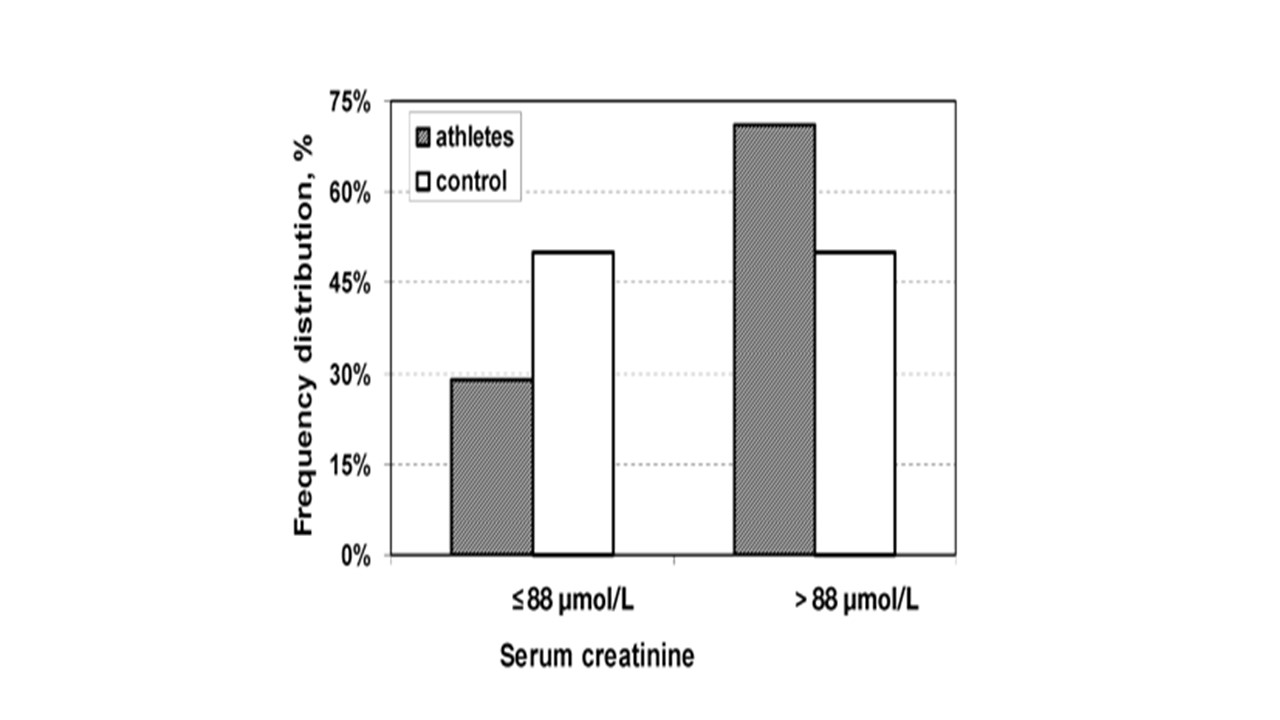
شکل ۵. بررسی درصد توزیع ورزشکاران و غیر ورزشکاران مرد در مقادیر کراتینین سرمی کمتر و بیشتر ۸۸ میکرومول/ لیتر
ارتباط بین کراتینین سرم و نوع رشته های ورزشی
به نظر می رسد در رشته های ورزشی استقامتی که معمولاً شاخص توده بدنی (BMI) کمتر از ویژگی های اصلی ورزشکاران این رشته ها است، مقادیر کراتینین سرم در مقایسه با افراد بی تحرک کمتر است. برای مثال مطالعه ای نشان داد مقادیر کراتینین سرم در اسکی بازان نوردیک (۳۷ نفر) و دوچرخه سواران (۸۰ نفر) در دامنه ای بین ۷۲/۰ – ۹۸/۰ میلی گرم بر دسی لیتر بود در حالی که کراتینین سرمی در آزمودنی های گروه کنترل بی تحرک (۶۰ نفر) در دامنه ای بین ۸۲/۰ – ۰۶/۱ میلی گرم بر دسی لیتر بود. بنابراین می توان گفت، نوع رشته ورزشی و ویژگی های متفاوت پیکر سنجی مربوط به ورزشکاران باعث ایجاد دامنه های گوناگونی از غلظت کراتینین می شود (۴).
پاسخ های کراتینین به تمرین و فعالیت ورزشی حاد
مقالاتی وجود دارد که تغییرات مقادیر کراتینین سرم را در پاسخ به تمرین مزمن و فعالیت ورزشی حاد توصیف کرده اند. به طور کلی، یافته ها نشان می دهد غلظت کراتینین سرم تحت تأثیر تمرین و رقابت قرار نمی گیرد، حتی در ورزش های سنگین. در بوکسورهای تایلندی (۲۰ نفر، سن = 17-۱۴ سال) ، مقدار کراتینین در طول تمرینات معمولشان، تمرینات شدید و بعد از یک مسابقه از نظر آماری با مقادیر گروه کنترل تفاوت نداشت. تفاوتی برای کلیرانس کراتینین نیز ارائه نشد، به استثنای پس از یک مسابقه، که در ورزشکاران در مقایسه با گروه کنترل کمتر بود که دلیل آن نیز به تغییرات احتمالی در همودینامیک کلیه (کاهش جریان خون کلیه) در طول مبارزه عنوان شد (۴). به علاوه در شانزده داوطلب شرکت کننده در یک مسابقه دوچرخه سواری فوق استقامت ۵۰۹ کیلومتری (دور تا دور آلپ) در ارتفاع ۳۰۰-۲۷۵۰ متری، مقادیر کراتینین سرم بلافاصله پس از پایان تلاش در مقایسه با مقادیر قبل از شروع مسابقه، افزایش قابل توجهی نشان داد. با وجود این، متوسط مقادیر کراتینین همیشه در حدود مرجع قرار داشتند و ۲۴ ساعت پس از پایان مسابقه به سطح پایه بازگشتند (۴). نویسندگان این مطالعه، اهمیت جایگزینی کافی مایعات توسط دوچرخه سواران حرفه ای فوق ماراتن را که در مجموع مقدار مایعات ۱۷ لیتر را در طول مسابقه مصرف کرده بودند، بیان کردند. همبستگی منفی و معناداری بین افزایش کراتینین سرم و کیلومترهای تمرینی انجام شده در طول سال قبل از مسابقه، اهمیت تمرین را برای هموارسازی و کاهش سطح و مدت زمان اختلال کلیه را بیان می کند (۴). کاهش کراتینین سرم هنگامی که برنامه های تمرینی سنگین تر هستند و مسابقات پی در پی اجرا می شوند نمی تواند با تغییرات در توده عضلانی همراه باشد و می تواند با تغییرات جریان خون و / یا حجم مایعات توضیح داده شود که به عنوان فرضیه ای در تعدیل کراتینین و اوره پس از تلاش ها در ورزشکاران استقامتی ذکر شد (۴).
نقش سیترولین ، اورنیتین و نیتریک اکساید در عملکرد و سازگاری های ورزشی
سیترولین یک ترکیب نیتروژنی غیر پروتئینی (NPN) است که در کنار اورنیتین و آرژنین اعضای آمینو اسیدی چرخه اوره را می سازد. سیترولین بر خلاف آرژنین به طور گسترده در همه پروتئین ها وجود ندارد. مقادیر سیترولین در هندوانه بیشترین حد است. به طور متوسط ۲.۱ میلی گرم سیترولین در هر گرم از وزن تر هندوانه وجود دارد و مصرف هندوانه می تواند آرژنین و سیترولین پلاسما را به صورت کوتاه مدت (۳.۳ کیلوگرم هندوانه معادل ۱۰ گرم مکمل ال-آرژنین است) افزایش دهد (۵). به علاوه مقادیر ناشتایی آرژنین و اورنیتین در دامنه ۱۲-۲۲ درصد پس از مصرف ۷۸۰-۱۵۶۰ گرم هندوانه در روز افزایش می یابد. سیترولین با استفاده از یکی از دو مسیر در بدن ایجاد می شود ، یا از آرژنین بازیافت می شود (تبدیل آرژنین به نیتریک اکسید باعث می شود که سیترولین به عنوان محصول جانبی باشد) یا از نیتروژن (و مقداری کربن) موجود در ال- گلوتامین تولید می شود. گلوتامین؛ که این مسیر آنزیم اورنیتین ترانس کربامیلاز از اورنیتین و کارباموئیل فسفات (که به گلوتامین نیاز دارد) برای تولید سیترولین در سلول های روده ای استفاده می کند. به نظر می رسد که مسیر آرژنین حدود ۱۰ درصد سیترولین در گردش را تشکیل می دهد در حالی که مسیر گلوتامین ۹۰ درصد را تشکیل می دهد (۵, ۷). کاهش سطح گلوتامین پلاسما می تواند سیترولین پلاسما را کاهش دهد. درباره چرخه اوره (یکی از مکانیسم های تولیدی سیترولین در حد ۱۰ درصد) ، آرژنین از راه آنزیم آرژیناز (۱) به اورنیتین تبدیل می شود (اوره را به عنوان یک کوفاکتور تولید می کند) و از آنجا اورنیتین (با استفاده از کارباموئیل فسفات به عنوان یک کوفاکتور) در معرض آنزیم اورنیتین کرباموئیل ترانسفراز (۲) سیترولین را تولید می کند. از این نظر، مسیر متابولیکی آرژنین به سمت سیترولین (از راه اورنیتین) باعث افزایش اوره و کاهش همزمان آمونیاک می شود، که توسط آنزیم کرباموئیل فسفات سنتاز برای تولید کارباموئیل فسفات استفاده می شود. در صورت نیاز، آرژنین می تواند مستقیماً از راه آرژنین دیمیناز به سیترولین تبدیل شود و به جای نیاز، حتی آمونیاک را تولید کند (۸). سیترولین تشکیل شده از این چرخه سپس با ال- آسپارتات (مربوط به D- آسپارتیک اسید به عنوان ایزومر آن) متصل می شود و از راه آنزیم آرژینوسوکاسینات سنتاز، آرژینوسوکینات را تشکیل می دهد و سپس آنزیم آرژینوسوکسینات لیزاز آرژینوسوکسینات را به آرژینین آزاد و فومارات تجزیه می کند (۵, ۷). آرژنین سپس دوباره وارد چرخه اوره می شود. فومارات نیز به راحتی می تواند به عنوان واسطه انرژی وارد چرخه TCA (كربس) شود، و سیترولین نیز به طور منفی آنزیم آرژیناز را تنظیم می كند. تبدیل سیترولین به آرژینوسوکسینات و تبدیل بعدی آن به آرژنین نیز در چرخه اکسید نیتریک به جای چرخه اوره دخیل است، تنها تفاوت در این است که آرژنین مستقیماً به سیترولین تبدیل می شود (با دادن یک مولکول اکسید نیتریک) به جای اینکه به طور غیر مستقیم از راه اورنیتین تولید شود (۵, ۷). به نظر می رسد عامل اصلی تبدیل سیترولین به آرژنین فقط غلظت سرمی سیترولین باشد که در حالت استراحت در محدوده ۲۲.۴-۲۷ میکرومول بر لیتر است (۹). به همین دلیل ، به نظر می رسد افزایش سیترولین پلاسما باعث افزایش خطی آرژنین تا حدود دوز ۵-۱۰ گرم شود در حالی که به نظر می رسد دوزهای خوراکی بالاتر باعث افزایش آرژنین کمتر از حد انتظار می شود (۱۰).
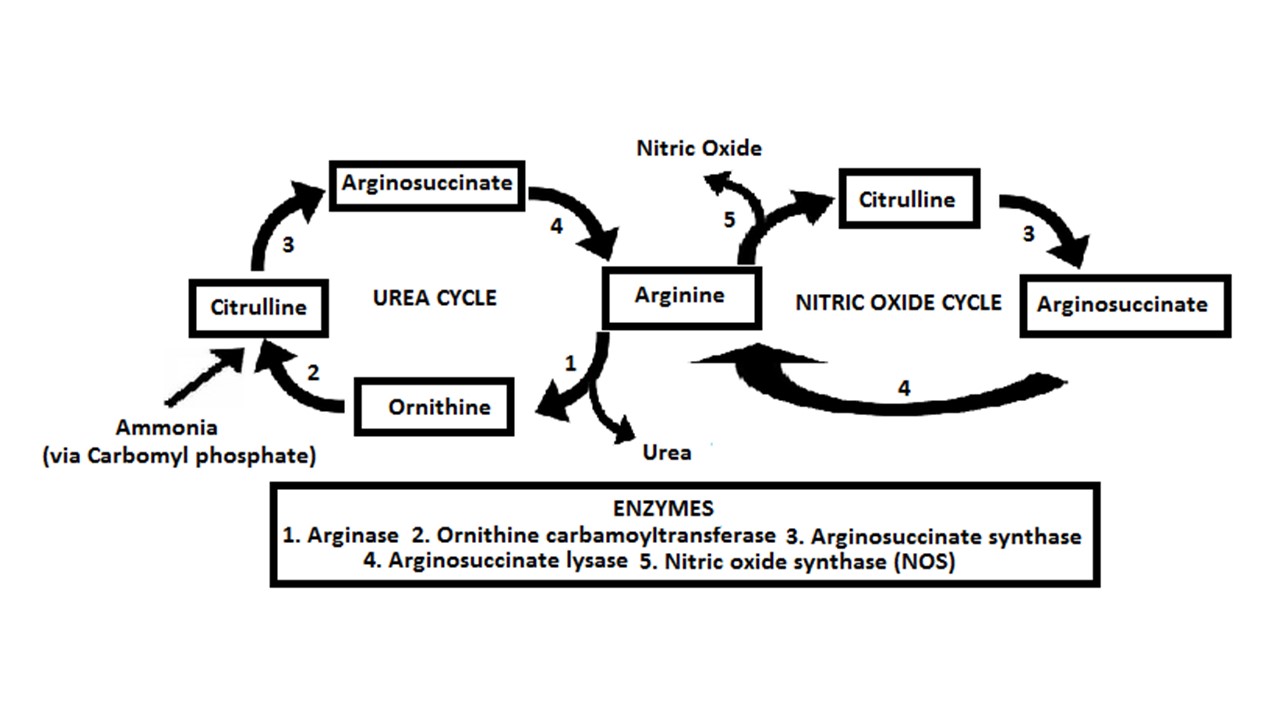
شکل ۶. مسیرهای های تولید سیترولین. مسیر سمت چپ نشان دهنده مسیر تولید سیتورلین از چرخه اوره است. مسیر سمت راست نیز تولید سیترولین از راه چرخه نیتریک اکساید را نشان می دهد.
سیترولین، عملکرد جسمانی و عضلات اسکلتی
بر پایه برخی از مطالعات، مکمل یاری سیترولین برای جرح و تعدیل آنزیم ها در مسیرهای گلیکوژنولیز (تجزیه گلیکوژن) و گلیکولیز (تبدیل گلوکز به ATP) در عضله اسکلتی موش صحرایی ذکر شده است که متابولیسم عضله را از انرژی هوازی (مبتنی بر اسیدهای چرب) به بی هوازی تغییر می دهد (۱۱). با وجود این، به نظر می رسد سیترولین توسط افزایش بازده تولید انرژی با تولید ATP تعامل برقرار می کند (به روشی سودمند)، اما مشخص نیست که آیا سیترولین باعث افزایش متابولیسم انرژی هوازی یا بی هوازی می شود (یا هر دو). برای مثال، مشخص شده است که سیترولین (به عنوان مالات) باعث افزایش کارایی ATP عضلانی می شود که پدیده مشابهی است که با مکمل یاری های نیترات و آرژنین به دلیل تولید نیتریک اکسید دیده می شود حداقل یک مطالعه در موش های صحرایی نشان داد، پس از مصرف ۳ گرم در کیلوگرم در روز (معادل ۴۸۰ میلی گرم در کیلوگرم وزن بدن انسان) ۲۳ درصد نیروی تولیدی را افزایش یافت (۱۲). سیترولین (به عنوان مالات) گاهی به عنوان یک بافر اسید و آمونیاک در پستانداران از جمله انسان استفاده می شود. به نظر می رسد، تجویز سیترولین باعث تحریک اوروژنز کبدی (از راه تجزیه آمونیاک از اورنیتین) می شود و در جاهای دیگر گفته شده است که به سادگی غلظت اورنیتین را افزایش می دهد (تقریباً دو برابر ، افزایش مشابه اورنیتین و آرژنین). به نظر می رسد ۶ گرم سیترولین باعث افزایش اورنیتین پلاسما (۲۰۰ درصد یا بیشتر) می شود البته نسبت به مکمل یاری اورنیتین در یک دوز مشابه (۳۰۰-۵۰۰ درصد) به میزان کمتری اورنیتین را افزایش می دهد (۱۳). معمولاً تجمع آمونیاک به دلیل مهار تبدیل پیروات به استیل CoA (ازراه فعال سازی فسفوفروکتوکیناز) سیگنالی برای خستگی عضلانی است که مانع از انقباض پذیری عضلات می شود. به نظر می رسد به طور ثانویه، مکمل یاری سیترولین با جلوگیری از تجمع آمونیاک (که در موش ها اثبات شده است) می تواند باعث بهبود عملکرد جسمانی شود (۱۴). به علاوه نشان داده شده است سیترولین بر مسیر mTOR (مولکول پیام رسان تحریک سنتز پروتئین در عضلات) تأثیر مثبت می گذارد، اما به نظر نمی رسد، این کار از راه فعال سازی مستقیم مانند لوسین باشد. در واقع در صورت وجود، سیترولین سیگنالینگ سرکوب شده mTOR را عادی می کند (۱۵). در مطالعات انسانی، مکمل یاری ۰.۱۸ گرم / کیلوگرم سیترولین به مدت یک هفته نتوانست اکسیداسیون لوسین یا سنتز پروتئین کل بدن را تغییر دهد اما در جای دیگر در همان دوز، بهبود تعادل نیتروژن در انسان نشان داده شده است(۱۶, ۱۷). به نظر نمی رسد نیتروژن ادراری حالت ناشتایی با دوز خوراکی سیترولین بین ۱۵-۱۵ گرم در کوتاه مدت تحت تأثیر قرار گیرد (۱۰). بنابراین شواهد متفاوتی درباره اینکه آیا مکمل سیترولین می تواند به سنتز پروتئین عضله کمک کند یا خیر وجود دارد (۷). به علاوه مداخلات نشان می دهند سیترولین ، وقتی در دوزهای حدود ۲۵۰ میلی گرم در کیلوگرم وزن بدن مکمل یاری شود، در افزایش عملکرد بی هوازی در رت ها و موش نقش دارد. در وزنه بردارانی که پروتکل تمرینی دارند (۸ نوبت/ تکرار تا سر حد خستگی) ، مصرف ۸ گرم سیترولین مالات در کنار ۱۰ گرم ساکارز (ساکارز نیز در شرایط دارونما ارائه شد) نتوانست عملکرد را در نوبت های ۱-۲ بهبود بخشد اما به تدریج مقدار تکرارهای انجام شده را نسبت به دارونما از ۱۰.۴۸درصد به ۵۲.۹۲ درصدافزایش داد (۱۸).
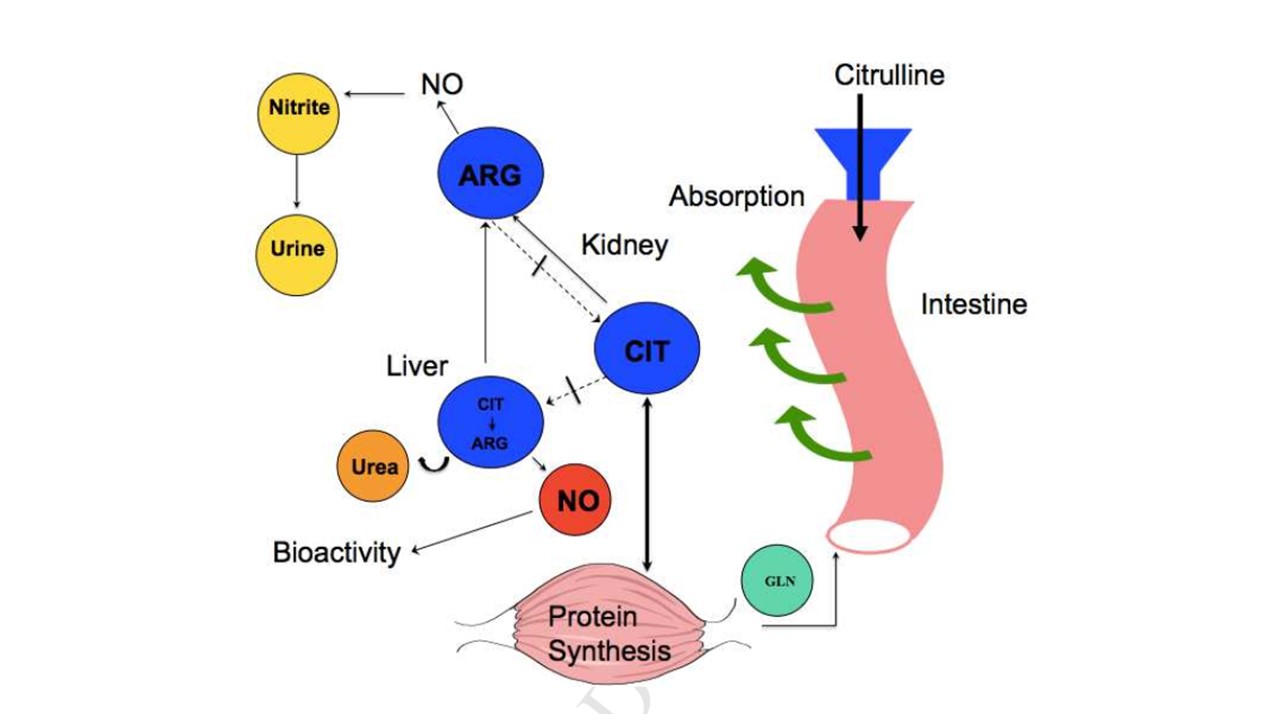
شکل ۹. آثار گوناگون مکمل یاری ال-سیترولین بر سازگاری های عملکردی و فیزیولوژیایی، NO: نیتریک اکساید، GLN گلوتامین، CIT: سیترولین، ARG: آرژنین. برگرفته از پاپادیا و همکارانش (۲۰۱۸).
در مجموع ال سیترولین، یک آمینو اسید غیر ضروری است که در درجه اول در هندوانه یافت می شود، و اخیراً توجه زیادی را به خود جلب کرده است چرا که باعث افزایش فراهمی زیستی ال-آرژنین و تولید نیتریک اکساید (NO) و در نتیجه افزایش عملکرد ورزشی می شود. طی دهه گذشته، مطالعات متعددی به بررسی ویژگی های ارگوژنیک ال-سیترولین در عملکرد ورزشی هوازی و بی هوازی پرداخته اند. در مجموع، مکمل خوراکی ال-سیترولین نشان داده است که باعث افزایش سیترولین، آرژنین و NOx پلاسمایی می شود. اگرچه افزایش جریان خون سازوکار پیشنهادی برای قابلیت ارگوژنیک ال-سیترولین است، اما شواهدی که از افزایش کوتاه مدت گشاد شدن عروقی و تزریق خون در بافت عضلانی پس از مصرف مکمل یاری ال سیترولین پشتیبانی می کند، کمیاب و متناقض است (۵). با این حال، چند مطالعه گزارش کرده اند، مکمل یاری سیترولین می تواند عملکرد ورزشس و ریکاوری را افزایش دهد. بر اساس شواهد موجود، به نظر می رسد دوز دراز مدت ( ۷روز) نسبت به پروتکل های تک دوز کوتاه مدت برای افزایش عملکرد ورزشی موثرتر باشد. به نظر می رسد حداقل دوز موثر سیترولین حدود ۳ گرم در روز باشد، در حالی كه حداكثر دوز موثر ممكن است تا ۱۰-۱۵ گرم در روز باشد. محصولات سیترولین مالات معمولاً نسبت سیترولین به مالات ۱به۱ یا ۲ به۱ را فراهم می كند. ، اگرچه اطلاعات علمی تا کنون نتوانسته است نسبت برچسب محصول مورد استفاده را مشخص کند (۵).
مطالعات گزارش شده از آثار ارگوژنیک سیترولین مالات، دوزهای ۶ تا ۸ گرم را ارائه می دهند که حداقل ۳ گرم ال- سیترولین را در هر دو نسبت فراهم می کند. معلوم نیست که چگونه مالات نقش بارزی در تاثیر ارگوژنیک سیترولین مالات فراهم می کند. بنابراین، ممکن است نسبت ۲ به۱ سیترولین به مالات ترجیح داده شود. سرانجام، به نظر می رسد بلع ال- سیترولین ۶۰-۹۰ دقیقه قبل از شروع فعالیت ورزشی با اطمینان بیشتری عملکرد را افزایش می دهد، چه به عنوان L- سیترولین و چه به عنوان سیترولین مالات مصرف شود. مطالعات آینده باید به بررسی آثار مکمل یاری کوتاه مدت و مزمن ال- سیترولین و سیترولین مالات بر روی نشانگرهای جریان خون و عملکرد ورزشی ادامه دهند و باید به دنبال روشن کردن مکانیزم اساسی چنین آثاری باشند (۵).
منابع
- Rusip G, Suhartini SM, Suen AB. Influence of exercise on plasma ammonia and urea after ingestion beverages of carbohydrate electrolyte. E&ES. 2018;130(1):012020.
- Finsterer J. Biomarkers of peripheral muscle fatigue during exercise. BMC musculoskeletal disorders. 2012;13(1):218.
- Patel SS, Molnar MZ, Tayek JA, Ix JH, Noori N, Benner D, et al. Serum creatinine as a marker of muscle mass in chronic kidney disease: results of a cross-sectional study and review of literature. Journal of cachexia, sarcopenia and muscle. 2013;4(1):19-29.
- Banfi G. Serum creatinine concentrations in athletes: are they normal? Brazilian Journal of Biomotricity. 2010;4(3):157-64.
- Gonzalez AM, Trexler ET. Effects of Citrulline Supplementation on Exercise Performance in Humans: A Review of the Current Literature. The Journal of Strength & Conditioning Research. 2020;34(5):1480-95.
- Banfi G, Del Fabbro M, Lippi G. Serum creatinine concentration and creatinine-based estimation of glomerular filtration rate in athletes. Sports Medicine. 2009;39(4):331-7.
- Papadia C, Osowska S, Cynober L, Forbes A. Citrulline in health and disease. Review on human studies. Clinical Nutrition. 2018;37(6):1823-8.
- Kuo MT, Savaraj N, Feun LG. Targeted cellular metabolism for cancer chemotherapy with recombinant arginine-degrading enzymes. Oncotarget. 2010;1(4):246.
- Sureda A, Córdova A, Ferrer MD, Pérez G, Tur JA, Pons A. L-citrulline-malate influence over branched chain amino acid utilization during exercise. European journal of applied physiology. 2010;110(2):341-51.
- Moinard C, Nicolis I, Neveux N, Darquy S, Benazeth S, Cynober L. Dose-ranging effects of citrulline administration on plasma amino acids and hormonal patterns in healthy subjects: the Citrudose pharmacokinetic study. British journal of nutrition. 2008;99(4):855-62.
- Faure C, Morio B, Chafey P, Le Plénier S, Noirez P, Randrianarison‐Huetz V, et al. Citrulline enhances myofibrillar constituents expression of skeletal muscle and induces a switch in muscle energy metabolism in malnourished aged rats. Proteomics. 2013;13(14):2191-201.
- Giannesini B, Le Fur Y, Cozzone PJ, Verleye M, Le Guern M-E, Bendahan D. Citrulline malate supplementation increases muscle efficiency in rat skeletal muscle. European journal of pharmacology. 2011;667(1-3):100-4.
- Demura S, Yamada T, Yamaji S, Komatsu M, Morishita K. The effect of L-ornithine hydrochloride ingestion on performance during incremental exhaustive ergometer bicycle exercise and ammonia metabolism during and after exercise. European journal of clinical nutrition. 2010;64(10):1166-71.
- Takeda K, Machida M, Kohara A, Omi N, Takemasa T. Effects of citrulline supplementation on fatigue and exercise performance in mice. Journal of nutritional science and vitaminology. 2011;57(3):246-50.
- Cynober L, de Bandt J-P, Moinard C. Leucine and citrulline: two major regulators of protein turnover. Nutrition in Intensive Care Medicine: Beyond Physiology. 105: Karger Publishers; 2013. p. 97-105.
- Thibault R, Flet L, Vavasseur F, Lemerle M, Ferchaud-Roucher V, Picot D, et al. Oral citrulline does not affect whole body protein metabolism in healthy human volunteers: results of a prospective, randomized, double-blind, cross-over study. Clinical Nutrition. 2011;30(6):807-11.
- Rougé C, Des Robert C, Robins A, Le Bacquer O, Volteau C, De La Cochetière M-F, et al. Manipulation of citrulline availability in humans. American Journal of Physiology-Gastrointestinal and Liver Physiology. 2007;293(5):G1061-G7.
- Pérez-Guisado J, Jakeman PM. Citrulline malate enhances athletic anaerobic performance and relieves muscle soreness. The Journal of Strength & Conditioning Research. 2010;24(5):1215-22.









دیدگاه خود را ثبت کنید
تمایل دارید در گفتگو شرکت کنید؟نظری بدهید!