فیزیولوژی انقباض عضلانی: مرور سازوکارها و ساختارها
نویسنده: علیرضا نیک نام (متخصص فیزیولوژی ورزشی)
آدرس صفحه اینستاگرام: Sportphysiologist@ آدرس ایمیل: Alireza73.Niknam@gmail.com
مقدمه
عضلات اسکلتی، بخش عمدهای از سیستم حرکتی انسان را تشکیل میدهند و عملکرد آنها متکی بر فرآیند انقباض عضلانی است. این انقباض، حاصل مکانیسمهای پیچیدهای در سطح سلولهای عضلانی (تارهای عضلانی) است که به دنبال تحریک عصبی و از طریق مکانیسم لغزشی فیلامانها رخ میدهد. شناخت دقیق این فرآیند، برای درک عملکرد حرکتی، سازگاریهای تمرینی، و درمان اختلالات عصبی-عضلانی ضروری است. در واقع انقباض عضلانی یک فرآیند پیچیده و هماهنگ بین سیستم عصبی و عضله است که از انتقال پیام عصبی آغاز شده و با تعامل بین فیلامانهای اکتین و میوزین منجر به تولید نیرو و حرکت میشود. در ادامه به بررسی گامبهگام مکانیسم انقباض عضله اسکلتی، نقش یون کلسیم، ATP، و پروتئینهای تنظیمکننده نظیر تروپونین و تروپومیوزین پرداخته ایم و دید جامعی از تعاملات عصبی-عضلانی در سطح سلولی و مولکولی ارائه خواهیم کرد.
کلمات کلیدی: انقباض عضلانی، میوزین، اکتین، تار عضلانی، سارکومر
سازوکار انقباض عضله اسکلتی
۱. تحریک عصبی و انتقال سیناپسی
فرآیند انقباض با ارسال پتانسیل عمل از نورون حرکتی آلفا آغاز میشود. این پیام عصبی از طریق پیوندگاه عصبی-عضلانی (صفحه محرکه انتهایی) به تار عضلانی منتقل میشود. در پایانه عصبی، استیلکولین آزاد شده و با گیرندههای نیکوتینی در غشای عضله (سارکولما) تعامل میکند. این امر موجب دپلاریزاسیون سارکولما (تحریک) و ایجاد پتانسیل عمل عضلانی در سطح غشاء عضلانی میشود.
آشنایی با اصطلاحات این مرحله:
الف. عصب حرکتی آلفا (Alpha Motor Neuron)
تعریف:
عصب حرکتی آلفا (α-motoneuron) نوعی نورون بزرگ و میِلندار است که در شاخ قدامی نخاع قرار دارد و مسئول کنترل تارهای عضلانی اسکلتی است. این نورونها بهطور خاص تارهای عضلانی اکسترافیوزال (extrafusal fibers) را عصبدهی میکنند که مستقیماً مسئول تولید نیرو و انقباض هستند.
ویژگیها و ساختار:
- جسم سلولی: در شاخ قدامی نخاع قرار دارد.
- آکسون میلندار: با سرعت بالا (تا ۱۲۰ متر بر ثانیه) پیام عصبی را به عضله میرساند.
- پایانه عصبی: به یک یا چند تار عضلانی متصل شده و در آنجا صفحه محرکه انتهایی را تشکیل میدهد.
وظایف اصلی:
- ایجاد انقباض ارادی: ارسال پتانسیل عمل به فیبر عضلانی و آزادسازی استیلکولین.
- تنظیم دقت حرکت: کنترل تعداد و نوع فیبرهای فعال (از طریق واحدهای حرکتی).
- پاسخ به رفلکسها: در رفلکسهای نخاعی مانند رفلکس کششی (مانند پتلا) نقش دارد.
ارتباط با واحد حرکتی (Motor Unit):
هر نورون حرکتی آلفا به همراه تمام فیبرهای عضلانی که آن را عصبدهی میکند، یک واحد حرکتی را تشکیل میدهد. تعداد فیبرهای عضلانی در هر واحد، بسته به نوع عضله، از چند عدد (برای حرکات دقیق) تا صدها عدد (برای قدرت زیاد) متفاوت است.
اهمیت بالینی:
اختلال در عملکرد نورونهای آلفا میتواند منجر به فلج، آتروفی عضلانی یا بیماریهایی مانند اسکلروز جانبی آمیوتروفیک (ALS) شود که در آن این نورونها تخریب میشوند.
ب. استیلکولین (Acetylcholine, ACh)
تعریف و نقش:
استیلکولین یک ناقل عصبی کلاسیک است که در پایانههای نورونهای حرکتی آلفا (Alpha motor neurons) ترشح میشود. وظیفهی اصلی آن، انتقال پیام عصبی از نورون به تار عضلانی است.
فرآیند عملکرد:
- زمانی که پتانسیل عمل به انتهای آکسون نورون حرکتی میرسد، کانالهای وابسته به ولتاژ کلسیم باز میشوند.
- ورود کلسیم باعث آزادسازی وزیکولهای حاوی استیلکولین به فضای سیناپسی میشود.
- استیلکولین به گیرندههای نیکوتینی (nAChR) روی غشای فیبر عضلانی در ناحیهٔ صفحهٔ انتهایی میچسبد.
- این اتصال باعث باز شدن کانالهای یونی و دپلاریزاسیون غشا میشود.
استیلکولین کلید آغاز پاسخ انقباضی است و بدون حضور یا عملکرد درست آن، تحریک عضلانی ممکن نیست. عملکرد آن توسط آنزیم استیلکولیناستراز (AChE) تنظیم و پایان داده میشود.
ج. صفحهٔ انتهایی محرکهٔ عصبی (Neuromuscular Junction – NMJ)
تعریف:
صفحهٔ انتهایی محل اتصال نورون حرکتی آلفا به تار عضلانی است و بهعنوان سیناپس شیمیایی بین آنها عمل میکند. این ناحیه شامل سه بخش اصلی است:
- پایانهٔ پیشسیناپسی: شامل وزیکولهای حاوی استیلکولین در انتهای نورون حرکتی.
- شکاف سیناپسی: فضای بین نورون و غشای عضله که استیلکولین در آن آزاد میشود.
- غشای پسسیناپسی (سارکولما): دارای گیرندههای نیکوتینی که به ACh پاسخ میدهند.
ویژگیهای خاص:
- دارای سطح وسیع چینخورده برای افزایش تراکم گیرندهها.
- ارتباط نزدیک با لولههای T برای هدایت سیگنال به عمق تار عضلانی.
- بخش کلیدی در شروع همهٔ انقباضات ارادی.
اهمیت بالینی:
اختلال در عملکرد این ناحیه میتواند باعث بیماریهایی مانند میاستنی گراویس شود که با ضعف عضلانی همراه است.
د. دپلاریزاسیون غشاء (Membrane Depolarization)
تعریف:
دپلاریزاسیون به تغییر در پتانسیل الکتریکی غشاء تار عضلانی گفته میشود، بهگونهای که داخل سلول نسبت به بیرون کمتر منفی یا حتی مثبت میشود.
مکانیسم:
- پس از اتصال استیلکولین به گیرندهها، کانالهای یونی باز شده و سدیم (Na⁺) به داخل سلول وارد میشود.
- ورود سدیم باعث کاهش اختلاف پتانسیل بین داخل و خارج غشاء (از حدود -۹۰ mV به آستانه حدود -۵۵ mV یا بیشتر) میشود.
- اگر این تغییر به آستانه برسد، پتانسیل عمل تولید و در طول سارکولما و T-tubules پخش میشود.
- در ادامه، کانالهای پتاسیم (K⁺) برای بازگرداندن غشاء به حالت استراحت باز میشوند (ریپلاریزاسیون).
نقش:
دپلاریزاسیون آغازگر انتشار سیگنال الکتریکی به شبکه سارکوپلاسمیک و آزاد شدن کلسیم است که خود محرک اصلی انقباض محسوب میشود.
۲. انتشار پتانسیل عمل در تار عضلانی
پتانسیل عمل از طریق لولههای عرضی (T-tubules) به عمق تار عضلانی هدایت میشود و باعث فعال شدن گیرنده دیهیدروپیریدین (DHP) در غشای T-tubule میشود. این گیرنده با گیرنده راینودین (RyR) در شبکه سارکوپلاسمیک (SR) ارتباط دارد و منجر به آزادسازی سریع یونهای کلسیم به داخل سیتوپلاسم میشود.
۳. نقش کلسیم در آغاز انقباض
کلسیم آزاد شده به زیرواحد C پروتئین تروپونین متصل میشود و باعث تغییر شکل کمپلکس تروپونین–تروپومیوزین میشود. این تغییر، محلهای اتصال روی فیلامان اکتین را برای اتصال میوزین در دسترس قرار میدهد و فرآیند انقباض آغاز میشود. تروپونین یک پروتئین تنظیمی است که در تارهای عضلانی یافت میشود و بهطور خاص در بخشهای آکتینی عضله اسکلتی و قلبی حضور دارد. تروپونین از سه زیرواحد مختلف تشکیل شده است که هرکدام نقش خاصی در فرآیند انقباض عضله دارند:
۱. تروپونین (TnC)
نقش:
تروپونین C مهمترین زیرواحد در اتصال به یون کلسیم است. زمانی که سطح کلسیم در سیتوزول افزایش مییابد، یونهای کلسیم به تروپونین C متصل میشوند و این تغییر ساختار باعث میشود که تروپونین I و تروپونین T تغییر شکل دهند و فضای اتصال بین آکتین و میوزین باز شود، که این امر منجر به شروع چرخه انقباض عضلانی میشود.
۲. تروپونین (TnI)
نقش:
تروپونین I نقش مهارکننده دارد و از اتصال آکتین و میوزین جلوگیری میکند. زمانی که کلسیم به تروپونین C متصل میشود، تروپونین I از محل اتصال آکتین-میوزین کنار میرود و اجازه میدهد که چرخه انقباض آغاز شود.
۳. تروپونین (TnT)
نقش:
تروپونین T مسئول اتصال تروپونین به آکتین است و کمک میکند تا کمپلکس تروپونین به طور صحیح به فیلامنتهای آکتین متصل شود. این زیرواحد باعث تنظیم ارتباط میان تروپونین و سایر پروتئینهای فیلامنتی میشود.
نقش تروپونینها در خستگی عضلانی:
خستگی عضلانی به تغییرات مختلفی در سطح سلولی، از جمله کاهش کارایی چرخه انقباض، بستگی دارد. تروپونینها نقش مهمی در این فرآیند دارند:
تغییر در حساسیت تروپونین C به کلسیم:
با افزایش مدت زمان انقباض و خستگی عضلانی، ممکن است حساسیت تروپونین C به کلسیم کاهش یابد. این به این معنی است که برای شروع چرخه انقباض، نیاز به سطح بالاتری از کلسیم در سیتوزول است. این کاهش حساسیت میتواند منجر به کاهش قدرت انقباض و افزایش خستگی شود.
تجمع محصولات متابولیکی:
کاهش pH محیط (ایجاد شرایط اسیدی) میتواند توانایی تروپونین C در اتصال به کلسیم را کاهش دهد، که به نوبه خود مانع از شروع مؤثر چرخه انقباض میشود.
تغییرات در ساختار تروپونینها:
در شرایط خستگی شدید، ممکن است تغییرات ساختاری در تروپونینها رخ دهد که باعث کاهش تعاملات بین آکتین و میوزین میشود و در نتیجه قدرت انقباض عضله کاهش مییابد.
در مجموع، نقش تروپونینها در خستگی عضلانی به دلیل کاهش حساسیت به کلسیم، اختلال در چرخه انقباض، و تغییرات متابولیک است که به ضعف عملکرد عضلانی منجر میشود.
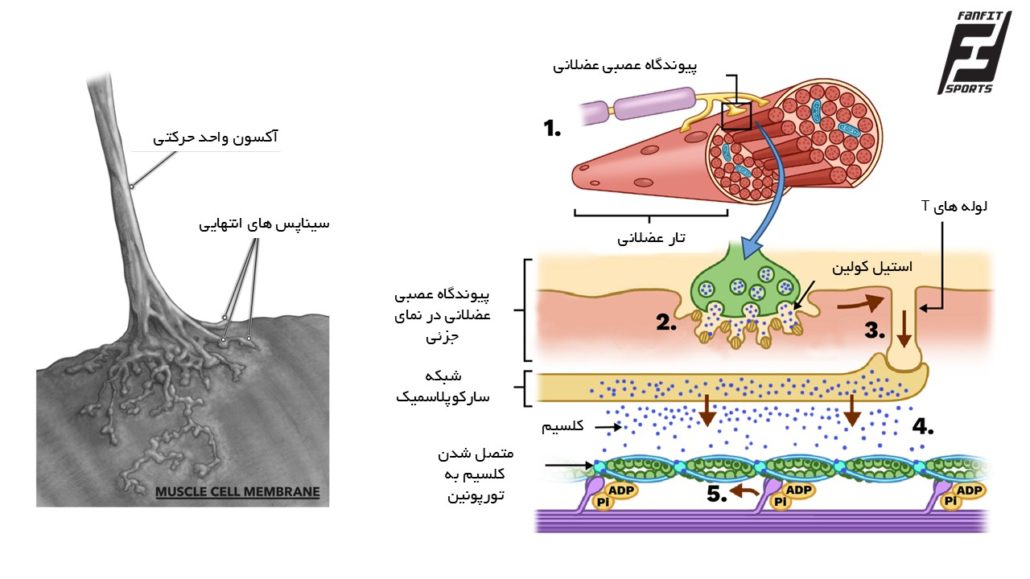
شکل ۱. فرایند جفت شدن تحریک و انقباض در تار عضلانی. از شروع تحریک عصبی تا اتصال کلسیم به تروپونین
۴. چرخه پلهای عرضی و تئوری فیلامان لغزان
در این مرحله، سرهای میوزین که حاوی آنزیم ATPase هستند، به جایگاه های فعال اکتین متصل میشوند. سپس با آزادسازی ADP و Pi، ضربه پرتوان (power stroke) رخ میدهد. اتصال ATP جدید باعث جدا شدن میوزین از اکتین و تجزیه آن، آمادهسازی سر میوزین برای چرخه بعدی را ممکن میسازد. این چرخه تا زمانی که کلسیم و ATP کافی در دسترس باشند، تکرار میشود.
چرخه پل عرضی فرآیندی است که در آن فیلامنتهای میوزین (فیلامنتهای ضخیم) و آکتین (فیلامنتهای نازک) در عضله اسکلتی برای ایجاد انقباض عضلانی با یکدیگر تعامل میکنند. این چرخه شامل دو مرحله کلی است:
۱- اتصال (Attachment):
در ابتدا، سرهای (myosin heads) فیلامنتهای میوزین به محلهای خاص روی فیلامنتهای آکتین متصل میشوند و تشکیل پل عرضی میدهند.
Power Stroke: سرهای میوزین با تغییر زاویه خود، فیلامنت آکتین را به سمت مرکز سارکومر میکشند که باعث کاهش طول سارکومر و انقباض عضلانی میشود.
۲- جدایش (Detachment):
برای شروع چرخه جدید، سرهای میوزین باید از آکتین جدا شوند. این جدایی پس از ورود مولکول ATP به سرهای میوزین رخ میدهد. ATP باعث تغییر شکل سرهای میوزین و آزاد شدن آنها از آکتین میشود.
هیدرولیز جزئی ATP: پس از جدایی از آکتین، ATP به ADP و فسفات تبدیل میشود و انرژی حاصل از این هیدرولیز باعث میشود سرهای میوزین به موقعیت آماده برای اتصال دوباره به آکتین برگردند.
این چرخه مداوم تا زمانی که کلسیم در سیتوزول وجود داشته باشد و ATP برای هدایت فرآیند در دسترس باشد، ادامه مییابد.
آشنایی بیشتر با پروتئین میوزین
میوزین یکی از پروتئینهای اصلی در انقباض عضلانی است و بهطور ویژه در عضله اسکلتی و عضله قلبی حضور دارد. میوزین یک پروتئین با ساختار پیچیده است که بهعنوان پروتئین محرک در فرآیند انقباض عضله عمل میکند. میوزین در واقع فیلامنتهای ضخیم است که در کنار فیلامنتهای نازک آکتین در سلولهای عضلانی قرار دارند و با آنها تعامل دارند تا فرآیند انقباض را امکانپذیر سازند. ساختار میوزین بهطور دقیق شامل چندین بخش است که هرکدام نقش خاصی در عملکرد انقباض عضلانی ایفا میکنند.
ساختار میوزین:
میوزین بهطور کلی از دو زیرواحد بزرگ پلیپپتیدی به نامهای رشته سنگین (Heavy Chain) و چندین رشته سبک (Light Chain) تشکیل شده است. این ساختار از دو بخش اصلی به نامهای سر (Head) و دم (Tail) تشکیل میشود.
سر میوزین (Myosin Head):
سر میوزین نقش اصلی در چرخه پل عرضی دارد. این بخش از میوزین مسئول اتصال به آکتین و انجام حرکت انقباضی است.
سر میوزین شامل دو بخش مهم است:
۱- محل اتصال به آکتین (Actin-binding site): این بخش به فیلامنتهای آکتین متصل میشود تا پل عرضی ایجاد کند.
2- محل اتصال به ATP (ATPase site): این بخش قادر به اتصال و هیدرولیز ATP است، که انرژی لازم برای انجام حرکت و تغییرات ساختاری را فراهم میکند.
همچنین، سر میوزین بهطور مستقیم در فرایند پولاریزاسیون و حرکت (Power Stroke) دخیل است. هنگام هیدرولیز ATP به ADP و فسفات، سر میوزین حرکت میکند و آکتین را به سمت مرکز سارکومر میکشد.
دم میوزین (Myosin Tail):
دم میوزین از دو رشته سنگین پلیپپتیدی بههم پیچیده تشکیل شده است و عمدتاً برای تثبیت و ترتیبدهی فیلامنتهای میریسین در درون سلول عضلانی اهمیت دارد.
دم میوزین در واقع بهعنوان یک لوله رابط عمل میکند که سرهای میوزین را به هم متصل میکند و در کنار هم قرار میدهد تا ساختار فیلامنتهای ضخیم تشکیل شود.
این بخش از میوزین بهعنوان ساختاری برای استحکام و چیدمان فیلامنتهای میوزین درون عضله بهکار میرود.
زنجیره های سبک میوزین (Myosin Light Chains):
زنجیره های سبک میوزین به سر میوزین متصل میشوند و نقشهای تنظیمی دارند. این رشتهها میتوانند در پاسخ به سیگنالهای سلولی تغییر شکل دهند و فعالیت سر میوزین را تنظیم کنند.
در عضلات اسکلتی، این رشتهها بیشتر به فعالیت ATPase سر میوزین مرتبط هستند و ممکن است بر عملکرد کلی چرخه پل عرضی تأثیر بگذارند.
ساختار کلی و چیدمان فیلامنتهای میوزین:
فیلامنتهای میوزین بهصورت پارالل و موازی در داخل عضله چیده شدهاند و در کنار فیلامنتهای نازک آکتین قرار میگیرند.
در هر فیلامنت میوزین، سرهای میوزین در بخشهای انتهایی بهطور فعال به آکتین متصل میشوند و در میانه فیلامنتها، دمهای میوزین به هم پیچیده میشوند و ساختار کلی را تشکیل میدهند.
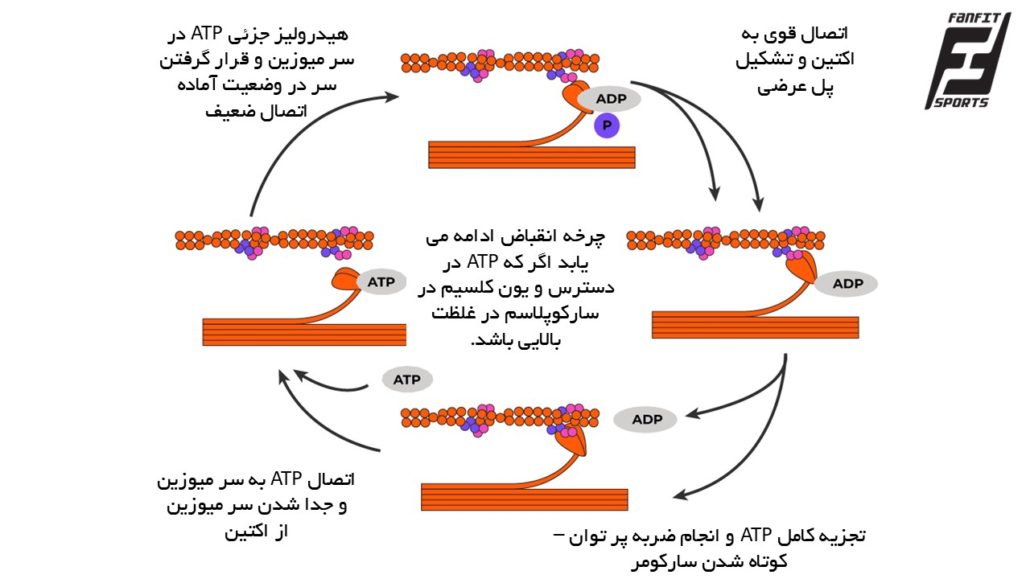
شکل ۲. چرخه انقباض عضلانی که از دو مرحله اتصال و جدایش تشکیل شده است
۵. بازگشت به حالت استراحت
پس از پایان تحریک، استیلکولین توسط آنزیم استیلکولیناستراز تخریب میشود. پمپ SERCA، کلسیم را به داخل SR بازمیگرداند، سطح کلسیم آزاد کاهش یافته و تروپومیوزین مجدداً محلهای اتصال را میپوشاند. در نتیجه، فیبر عضلانی به حالت استراحت بازمیگردد.
جمود نعشی (Rigor Mortis):
جمود نعشی یک وضعیت فیزیولوژیکی است که پس از مرگ رخ میدهد و در آن عضلات بدن بهطور کامل منقبض میشوند و بدن دچار سختی میشود. این پدیده بهطور خاص به عدم وجود ATP و در نتیجه عدم توانایی در فرآیند تفکیک پل عرضی مربوط است. جمود نعشی شامل مراحل زیر است:
عدم تولید ATP:
پس از مرگ، به دلیل توقف فرآیند متابولیسم سلولی و کاهش سطح ATP، سرهای فیلامنتهای میوزین نمیتوانند از آکتین جدا شوند.
اتصال ماندگار پل عرضی:
در غیاب ATP، سرهای میوزین بهطور دائمی به آکتین متصل میمانند و پلهای عرضی ثابت میمانند. این وضعیت منجر به سخت شدن عضلات و بروز جمود نعشی میشود.
پایان جمود نعشی:
پس از گذشت چند روز، آنزیمها و تخریب بافتی شروع به شکستن پروتئینهای ساختاری مانند آکتین و میوزین میکنند که این امر باعث کاهش جمود نعشی و شل شدن عضلات میشود.
رابطه چرخه پل عرضی و جمود نعشی:
چرخه پل عرضی و جمود نعشی از نظر فیزیولوژیکی بهطور مستقیم بههم مرتبطاند. در حالت عادی، زمانی که ATP در دسترس است، سرهای میوزین به طور مداوم از آکتین جدا میشوند و دوباره متصل میشوند که منجر به انقباض عضلانی میشود. اما پس از مرگ، عدم وجود ATP باعث میشود که پلهای عرضی دائماً به آکتین متصل بمانند، که بهطور موقت باعث انقباض دائمی عضلات میشود و جمود نعشی ایجاد میشود. این وضعیت نشاندهنده اهمیت حیاتی ATP در فرآیند انقباض عضلانی و تفکیک پلهای عرضی است.
خلاصه نکات مهم
مراحل انقباض عضله اسکلتی به ترتیب وقوع:
۱. تحریک عصبی (تحریک نورونی)
آغاز انقباض با پتانسیل عمل نورون حرکتی آلفا است.
این پتانسیل عمل به پایانه عصبی (نهایت آکسون) در عضله میرسد و سبب آزادسازی استیلکولین (ACh) به داخل فضای سیناپسی در محل اتصال عصبی-عضلانی (NMJ) میشود.
استیلکولین به گیرندههای نیکوتینی در غشای عضله (سارکولما) متصل میشود.
این اتصال موجب باز شدن کانالهای سدیمی و ایجاد پتانسیل انتهایی حرکتی (EPP) و سپس پتانسیل عمل عضلهای میشود.
۲. هدایت پتانسیل عمل در تار عضلانی
پتانسیل عمل از سارکولما به داخل لولههای T (T-tubules) هدایت میشود.
این لولهها در تماس با شبکه سارکوپلاسمیک (SR) هستند، که مخزن کلسیم در عضله است.
در محل تریاد (T-tubule + 2 terminal cisternae)، پتانسیل عمل موجب فعال شدن پروتئین دیهیدروپیریدین (DHP receptor) در T-tubule میشود.
۳. آزادسازی کلسیم از SR
DHP receptor بهطور مکانیکی با گیرنده راینودین (RyR) در SR ارتباط دارد.
تحریک DHP سبب باز شدن کانالهای کلسیمی RyR در SR و رهاسازی کلسیم (Ca²⁺) به سیتوپلاسم (سارکوپلاسم) میشود.
۴. تعامل کلسیم با عناصر انقباضی (مکانیسم لغزشی)
کلسیم به تروپونین C متصل میشود.
این اتصال سبب تغییر پیکربندی کمپلکس تروپونین–تروپومیوزین میشود.
تروپومیوزین از محلهای اتصال میوزین روی اکتین کنار میرود.
سرهای میوزین (که دارای آنزیم ATPase هستند) به محلهای فعال اکتین متصل میشوند.
پلهای عرضی (cross-bridges) بین میوزین و اکتین تشکیل میشود.
۵. چرخه انقباض (Sliding Filament Theory)
این بخش همان چیزی است که گایتون و وندرز تحت عنوان “نظریه فیلامان لغزان” معرفی میکنند:
مراحل:
اتصال میوزین به اکتین (در حضور کلسیم).
ضربه پر توان (Power Stroke): سر میوزین که ATP را هیدرولیز کرده، ADP و Pi را آزاد میکند.
این امر باعث خم شدن سر میوزین و کشیدن فیلامان اکتین به سمت مرکز سارکومر میشود.
جدایی میوزین از اکتین: اتصال ATP جدید به سر میوزین باعث جدا شدن آن از اکتین میشود.
بازتنظیم سر میوزین (Re-cocking): ATP به ADP و Pi تجزیه میشود و انرژی آزاد شده باعث بازگشت سر میوزین به وضعیت اولیه میشود.
این چرخه تا زمانی که کلسیم و ATP موجود باشد، تکرار میشود.
۶. پایان انقباض (شلشدن عضله)
پس از پایان تحریک عصبی:
استیلکولین توسط آنزیم استیلکولیناستراز تجزیه میشود.
کانالهای کلسیمی بسته میشوند.
کلسیم بهوسیله پمپ SERCA (کلسیم-ATPase) به داخل SR بازگردانده میشود.
با کاهش کلسیم آزاد، تروپونین به وضعیت اولیه بازمیگردد.
تروپومیوزین دوباره محلهای اتصال میوزین بر روی اکتین را میپوشاند.
فیلامانها به وضعیت استراحت برمیگردند.
کارکرد هر یک از مولکول ها در انقباض عضلانی:
استیلکولین (ACh): شروع پتانسیل عمل عضله
DHP receptor: حسکننده ولتاژی در T-tubule
RyR: کانال کلسیم در SR
کلسیم: آغازگر چرخه اتصال میوزین به اکتین
تروپونین و تروپومیوزین: کنترلکننده در دسترس بودن محلهای اتصال
ATP: انرژی برای اتصال و جدا شدن میوزین از اکتین، ضربه پر توان
SERCA pump: بازگرداندن کلسیم به SR و خاتمه انقباض
خود را بیازمایید: سازوکارهای انقباض عضلانی
۱. کدامیک از گزینههای زیر اولین مرحله در آغاز انقباض عضلانی است؟
a) آزاد شدن یونهای کلسیم از سارکوپلاسمی رتیکولوم
b) اتصال استیلکولین به گیرندههای عضله
c) اتصال سرهای میوزین به آکتین
d) دپولاریزاسیون غشای عضله
۲. استیلکولین (Acetylcholine) چه نقشی در آغاز انقباض عضلانی دارد؟
a) کاهش غلظت کلسیم در سارکوپلاسم
b) تحریک آزادسازی ATP از میتوکندریها
c) دپولاریزه کردن غشای سلولی عضله
d) انتقال سیگنال عصبی از مغز به عضله
۳. فرآیند دپولاریزاسیون غشای سلولی عضله در اثر استیلکولین باعث چه چیزی میشود؟
a) ورود یونهای کلسیم به داخل فیبر عضلانی
b) آزاد شدن یونهای کلسیم از سارکوپلاسمی رتیکولوم
c) اتصال میوزین به آکتین
d) انقباض سارکومر
۴. کلسیم آزاد شده از سارکوپلاسمی رتیکولوم به کدام پروتئین در عضله متصل میشود؟
a) توپولین
b) تروپونین
c) آکتین
d) میوزین
۵. نقش تروپونین I در چرخه انقباض عضلانی چیست؟
a) اتصال به کلسیم و تغییر شکل آن
b) مسدود کردن محل اتصال میوزین به آکتین در وضعیت استراحت
c) فعالسازی سرهای میوزین برای پیوستن به آکتین
d) تنظیم فشار در فیلامنتهای آکتین
۶. کدام یک از مراحل زیر باعث ایجاد حرکت پل عرضی در چرخه انقباض عضلانی میشود؟
a) اتصال استیلکولین به گیرندههای عضله
b) اتصال سرهای میوزین به آکتین
c) آزاد شدن کلسیم از سارکوپلاسمی رتیکولوم
d) فسفریلاسیون ADP
۷. چه چیزی باعث ایجاد جمود نعشی (Rigor Mortis) پس از مرگ میشود؟
a) کاهش سطح کلسیم در عضله
b) کمبود ATP برای جداسازی سرهای میوزین از آکتین
c) آزاد شدن بیش از حد کلسیم از سارکوپلاسمی رتیکولوم
d) عدم تحریک استیلکولین در صفحه محرکه انتهایی عصبی
۸. کدام یک از اجزای زیر مسئول آزادسازی کلسیم از سارکوپلاسمی رتیکولوم است؟
a) گیرندههای دی هیدروپیرین
b) گیرندههای راینودین
c) گیرندههای استیلکولین
d) سارکولما
۹. در چرخه انقباض عضلانی، سرهای میوزین پس از اتصال به آکتین:
a) با استفاده از انرژی ATP حرکت میکنند
b) به حالت کشش در میآیند و انقباض ایجاد میکنند
c) به توپولین متصل میشوند
d) به سارکولما متصل میشوند
۱۰. کدام یک از مراحل زیر در پایان انقباض عضلانی رخ میدهد؟
a) کاهش سطح کلسیم در سارکوپلاسم
b) اتصال دوباره میوزین به آکتین
c) افزایش سطح کلسیم در سارکوپلاسم
d) دپولاریزاسیون دوباره غشای عضله
پاسخهای صحیح:
b) اتصال استیلکولین به گیرندههای عضله
c) دپولاریزه کردن غشای سلولی عضله
b) آزاد شدن یونهای کلسیم از سارکوپلاسمی رتیکولوم
b) تروپونین
b) مسدود کردن محل اتصال میوزین به آکتین در وضعیت استراحت
b) اتصال سرهای میوزین به آکتین
b) کمبود ATP برای جداسازی سرهای میوزین از آکتین
b) گیرندههای راینودین
a) با استفاده از انرژی ATP حرکت میکنند
a) کاهش سطح کلسیم در سارکوپلاسم









دیدگاه خود را ثبت کنید
تمایل دارید در گفتگو شرکت کنید؟نظری بدهید!