سیستم های انرژی در ورزش: ۳-فسفوریلاسیون اکسایشی یا سیستم هوازی
نویسنده: علیرضا نیک نام (متخصص فیزیولوژی ورزشی)
آدرس صفحه اینستاگرام: Sportphysiologist@ آدرس ایمیل: Alireza73.Niknam@gmail.com
مقدمه
فسفوریلاسیون اکسایشی فرآیندی است که در آن الکترون های پرانرژی NADH/FADH از طریق کمپلکس های مختلف واقع در غشای داخلی میتوکندری منتقل می شوند و در نهایت به اکسیژن مولکولی می رسند. این انتقال الکترون منجر به پمپاژ پروتون ها به فضای بین غشایی میتوکندری می شود و یک گرادیان الکتروشیمیایی ایجاد می کند که برای سنتز ATP استفاده می شود. بنابراین میتوکندری ها جایگاه اصلی مسیر تولید انرژی هوازی یا فسفوریلاسیون اکسایشی هستند. در اکثر انواع سلول، فسفوریلاسیون اکسایشی مکانیسم اولیه برای تولید ATP است، به جز در سلول های خاصی مانند گلبول های قرمز. گلبول های قرمز خون فاقد میتوکندری هستند و به همین علت نمی توانند از مسیر فسفوریلاسیون اکسایشی ATP را تولید کنند.
کلمات کلیدی: سیستم هوازی، فسفوریلاسیون اکسایشی، انرژی هوازی، بتا-اکسیداسیون، چربی سوزی
فسفوریلاسیون اکسایشی یا فسفوریلاسیون مرتبط با انتقال الکترون یا اکسیداسیون پایانی، مسیر سوخت و سازی است که در آن سلول ها از آنزیم ها مواد مغذی (اسید های چرب، گلوگز {پیروات} و اسید های امینه) را اکسید می کنند و در نتیجه انرژی شیمیایی موجود در ان ها برای تولید آدنوزین تری فسفات یا ATP آزاد می کنند. این مسیر بازتولید ATP بسیار فراگیر است زیرا انرژی بیشتری نسبت به مسیرهای تولید انرژی جایگزین مانند گلیکولیز بی هوازی آزاد می کند.
در این مسیر انرژی ذخیره شده در پیوندهای شیمیایی زنجیره های کربنی مانند گلوکز یا اسید های چرب آزاد، توسط سلول در چرخه اسید سیتریک (چرخه کربس) آزاد می شود و دی اکسید کربن و اهداکنندگان الکترون NADH و FADH تولید می شوند.در طول فسفوریلاسیون اکسایشی، الکترونها از اهداکنندگان الکترون به یک سری از گیرندههای الکترون در یک سری واکنشهای ردوکس (اکسایش-احیا) که به اکسیژن ختم میشوند، منتقل میشوند.
بنابراین فسفوریلاسیون اکسایشی از این مولکول ها و O2 برای تولید ATP استفاده می کند، به همین علت نام این مسیر بازتولید ATP سیستم انرژی هوازی است. اگرچه فسفوریلاسیون اکسایشی بخش مهمی از سوخت و ساز است، اما گونه های فعال اکسیژن مانند سوپراکسید و پراکسید هیدروژن را تولید می کند که منجر به انتشار رادیکال های آزاد، آسیب رساندن به سلول ها و احتمالاً پیری می شود.
آشنایی با NADH و نقش آن در فسفوریلاسیون اکسایشی:
بسیاری از فرآیندهای بیوشیمیایی کاتابولیک، مانند گلیکولیز، چرخه اسید سیتریک (چرخه کربس) و بتا-اکسیداسیون، کوآنزیم های احیایی NADH را تولید می کنند. نیکوتین آمید آدنین دی نوکلئوتید (NAD) یک کوآنزیم مرکزی در سوخت و ساز است.NAD که در تمام سلول های زنده یافت می شود، دی نوکلئوتید نامیده می شود زیرا از دو نوکلئوتید تشکیل شده است که از طریق گروه های فسفات آن ها به هم متصل شده اند.یک نوکلئوتید حاوی باز آدنین نوکلئوتید و دیگری نیکوتین آمید است.
NAD به دو شکل وجود دارد: شکل اکسید شده و احیا شده که به ترتیب +NAD و NADH (H برای هیدروژن) مخفف می شوند.در متابولیسم سلولی، NAD در واکنشهای ردوکس نقش دارد و الکترونها را از یک واکنش به واکنش دیگر حمل میکند، بنابراین به دو شکل یافت میشود: +NAD یک عامل اکسید کننده است، الکترونها را از مولکولهای دیگر میپذیرد و با +H احیا می شود که این واکنش NADH را تشکیل می دهد که می تواند به عنوان یک عامل احیا کننده برای اهدای الکترون استفاده شود.
این واکنش های انتقال الکترون عملکرد اصلی NAD هستند. بنابراین هرگاه کوانزیم NADH تشکیل شود یعنی حاوی الکترون هایی است که پتانسیل انتقال بالایی دارند.به عبارت دیگر، آنها با اکسید شدن مقدار زیادی انرژی آزاد می کنند.با این حال، سلول این انرژی را به یکباره آزاد نمی کند، زیرا این یک واکنش غیرقابل کنترل خواهد بود.در عوض، الکترون ها از NADH حذف می شوند و از طریق یک سری آنزیم به اکسیژن منتقل می شوند که هر کدام مقدار کمی از انرژی را آزاد می کنند.
این مجموعه از آنزیم ها که از کمپلکس های I تا IV تشکیل شده است، زنجیره انتقال الکترون نامیده می شود و در غشای داخلی میتوکندری یافت می شود. دآنزیم های زنجیره انتقال الکترون از انرژی آزاد شده توسط انتقال الکترون NADH برای پمپاژ پروتون ها به فضای بین غشایی میتوکندری استفاده می کنند.این باعث افزایش پروتون در فضای بین غشایی می شود و یک گرادیان الکتروشیمیایی در سراسر غشاء ایجاد می کند.سپس انرژی ذخیره شده در این پتانسیل توسط ATP سنتاز برای تولید ATP استفاده می شود.
آشنایی با FADH و نقش آن در فسفوریلاسیون اکسایشی:
در بیوشیمی، فلاوین آدنین دی نوکلئوتید (FAD) یک کوآنزیم ردوکس فعال مرتبط با پروتئین های مختلف است که با چندین واکنش آنزیمی در سوخت و ساز درگیر است. برخی از فلاووپروتئین ها شناخته شده عبارتند از: اجزای کمپلکس سوکسینات دهیدروژناز، α-کتوگلوتارات دهیدروژناز، و جزئی از کمپلکس پیروات دهیدروژناز.FAD در شکل کاملا احیا شده یا کینون، دو الکترون و دو پروتون را می پذیرد تا به FADH2 (شکل هیدروکینون) تبدیل شود.
بنابراین FADH2 نیز دقیقا شبیه به NADH پتنسیل بازتولید ATP را به واسطه مکانزیم های وابسته به زنجیره انتقال الکترون را دارد با این تفاوت در مقایسه با NADH پتانسیل کمتری برای بازتولید ATP دارد. دلیل این موضوع نیز آن است که تعداد پروتون های پمپ شده به واسطه FADH2 در مقایسه با NADH به فضای بین غشایی میتوکندری کمتر است.
بنابراین گرادیان الکتروشیمیایی کمتری را در غشا ایجاد می کند و در نتیجه پتانسل کمتری برای بازتولید ATP از راه ATP سنتاز دارد.
آشنایی با چرخه کربس یا اسید سیتریک و نقش ان در فسفوریلاسیون اکسایشی:
چرخه اسید سیتریک که به نامهای چرخه کربس، چرخه TCA (چرخه اسید تری کربوکسیلیک) نیز شناخته میشود، مجموعهای از واکنشهای بیوشیمیایی برای آزاد کردن انرژی ذخیره شده در مواد مغذی از طریق اکسیداسیون استیل کوآ حاصل از کربوهیدرات ها، چربی ها و اسیدهای آمینه است.این چرخه استات (به شکل استیل-CoA) و آب مصرف می کند، NAD+ را به NADH و FAD را به FADH2 تبدیل می کند و دی اکسید کربن آزاد می کند.
علاوه بر این به ازای هر مول استیل کوآ که وارد چرخه کربس می شود ۱ مول GTP یا ATP تولید می شود. NADH و FADH2 تولید شده توسط چرخه اسید سیتریک به مسیر زنجیره انتقال الکترون وارد می شود و در نتیجه به تولید ATP منجر می شود.در سلول ها، چرخه اسید سیتریک در ماتریکس میتوکندری رخ می دهد. نکته ای که باید توجه داشت این است که چرخه کربس یک مسیر متابولیک است که سوخت و ساز کربوهیدرات، چربی و پروتئین را به هم متصل می کند.
به عبارت دیگر، همه منابع انرژی اعم از قند، چربی و پروتئین می توانند انرژی نهفته در خود را از طریق چرخه کربس به حامل های الکترون تبدیل کننده و در ادامه انرژی نهفته در حامل های الکترون نیز توسط زنجیره انتقال الکترون به ATP تبدیل شود. واکنش های چرخه کربس توسط هشت آنزیم انجام می شود که طی آن استیل-CoA (یک مولکول ۲ کربنه) را به طور کامل اکسید می کنند و به دو مولکول دی اکسید کربن، آب، GTP و NADH/FADH2 تبدیل می کنند.
هر بار که چرخه کربس طی می شود سه NADH، یک FADH2 و ۱ مولکول GTP/ATP تولید می شود. بنابراین به طور خلاصه چرخه کربس شامل یک مجموعه واکنش شیمیایی است که طی آن استیل کوآ به طور کامل اکسید می شود و در نتیجه NADH، FADH2 و ATP تولید می شود. استیل-کوآ نیز به واسطه مسیرهای شیمیایی گلیکولیز هوازی (تجزیه قندها) و بتا-اکسایش (اسیدهای چرب) فراهم می شود.
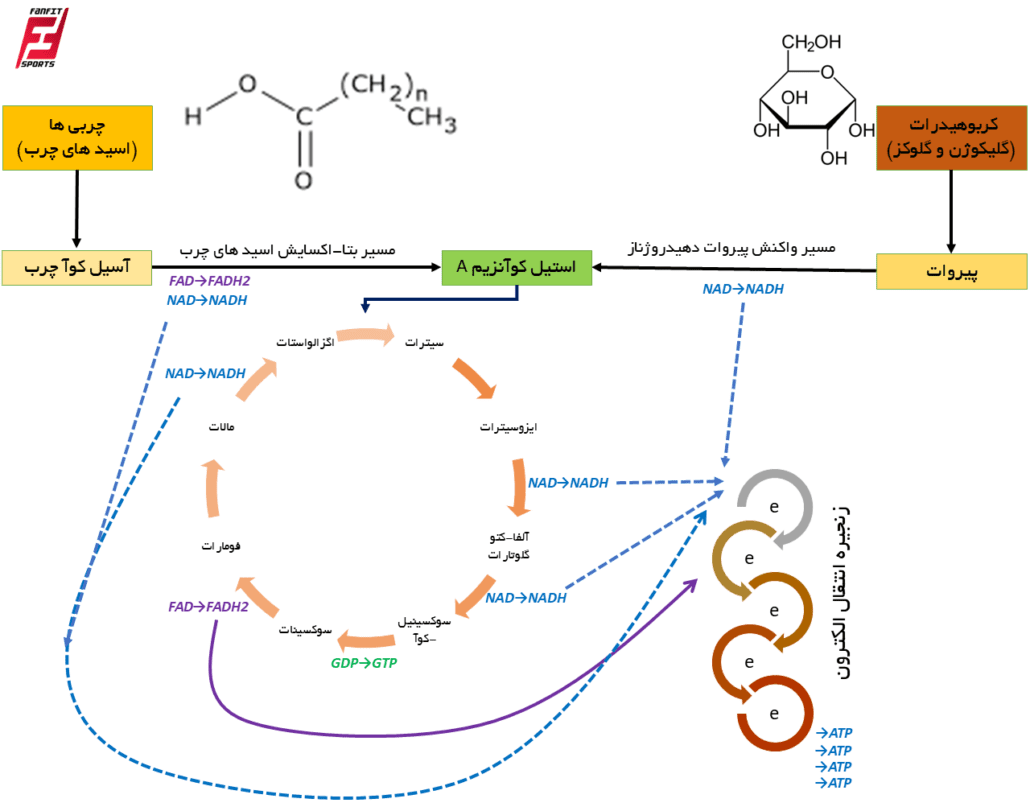
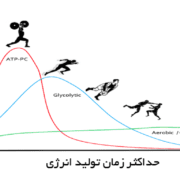
همانطور می توانید در شکل مشهود است، مسیر فسفوریلاسیون اکسایشی در مقایسه با مسیرهای فسفاژن و گلیکولیز بی هوازی بسیار پیچیده تر است و برای همین سرعت فراهمی ATP در آن به آهستگی طی می شود در عوض مقادیر ATP تولید در مقایسه با دو مسیر مذکور بسیار بیشتر است. به طوریکه مقادیر ATP تولید از یک مول گلوکز در مسیر هوازی برابر با ۳۶ مول ATP است. همچنین مقادیر ATP تولید از یک اسید چرب ۱۶ کربنه برابر با ۱۲۹ مول ATP است.
زنجیره انتقال الکترون
زنجیره انتقال الکترون (Electron Transport Chain) مجموعهای از پروتئینها است که الکترونها را در طول غشای میتوکندری مطابق با شیب پروتون برای تولید ATP منتقل میکنند. ATP به عنوان واحدهای انرژی برای فرایندهای متابولیکی سلولها مورد استفاده قرار میگیرد. در طی زنجیره انتقال الکترون، یک گرادیان پروتون ایجاد میشود تا پروتونها از ماتریکس میتوکندری به فضای بین غشایی سلول پمپ شوند که این امر به تسهیل تولید ATP نیز کمک میکند.
غالباً، استفاده از گرادیان پروتون به عنوان مکانیسم «کمو اسموتیک» (Chemiosmotic) که سنتز ATP را هدایت میکند، شناخته میشود. مکانیسم کمو اسموتیک به تولید غلظت بالاتری از پروتونها برای تولید نیروی محرکه پروتون متکی است. مقدار ATP ایجاد شده به طور مستقیم با تعداد پروتونهایی که در غشای داخلی میتوکندری پمپ میشوند، متناسب است. زنجیره حمل و نقل الکترونی شامل یک سری واکنشهای اکسیداسیون و احیا است که برای انتقال الکترونها از یک مولکول دهنده به یک مولکول پذیرنده، متکی به کمپلکسهای پروتئینی است.
در نتیجه این واکنشها، گرادیان پروتون تولید میشود و این امکان را فراهم میآورند تا کار مکانیکی به انرژی شیمیایی تبدیل شود و سنتز ATP صورت گیرد. این کمپلکسها در غشای میتوکندری داخلی در بخشهایی به نام «کریستا» (Cristae) در یوکاریوتها تعبیه شدهاند. ماتریکس توسط غشای داخلی میتوکندری محصور شده است و درون آن، آنزیمهای لازم مانند «پیروات دهیدروژناز» (Pyruvate Dehydrogenase) و «پیروات کربوکسیلاز» (Pyruvate Carboxylase) قرار دارند. فرآوردههای جانبی از چرخهها و فرآیندهای دیگر مانند چرخه اسید سیتریک یا کربس، اکسیداسیون اسید آمینه و اکسیداسیون اسید چرب در زنجیره انتقال الکترونی مورد استفاده قرار میگیرند.
زنجیره انتقال الکترون آخرین مرحله از تنفس هوازی و تنها بخشی از متابولیسم گلوکز است که از اکسیژن اتمسفر استفاده میکند. اکسیژن به طور مداوم از طریق دستگاه تنفسی وارد بدن میشود. حمل و نقل الکترون مجموعهای از واکنشهای اکسیداسیون و احیا را در بر میگیرد که در آنها الکترونها به سرعت از یک جز به قسمت دیگر منتقل میشوند تا در انتهای زنجیره الکترونها به اکسیژن مولکولی رسیده و آن را احیا کنند و مولکولهای آب تولید شوند.
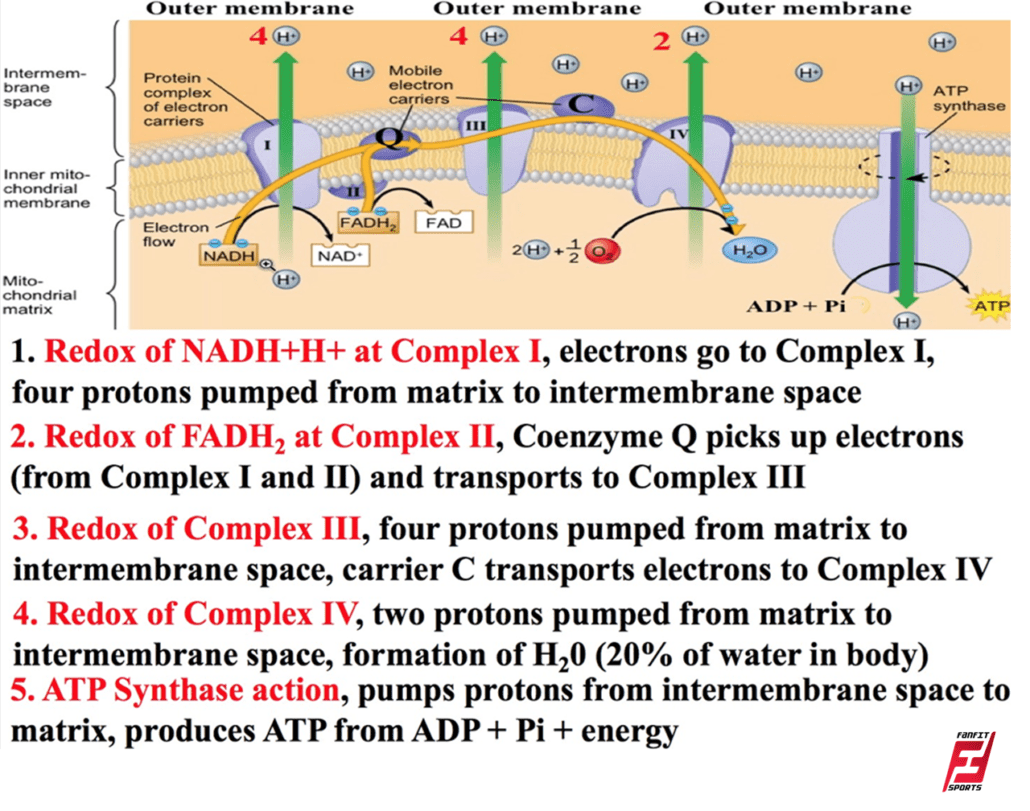
چهار کمپلکس از پروتئینها وجود دارند که در تصویر آنها با برچسب I تا IV نشان داده شدهاند و جمع شدن این چهار کمپلکس به همراه حاملهای الکترونی و ترکیبات دیگر، زنجیره انتقال الکترون نامیده میشوند. این زنجیره در چندین نسخه در غشای داخلی میتوکندری یوکاریوتها و غشای پلاسمایی پروکاریوتها وجود دارد. ویژگی مشترک همه زنجیرههای انتقال الکترون وجود پمپ پروتون برای ایجاد شیب پروتون در سراسر یک غشا است.
کمپلکس یک
برای شروع، دو الکترون به اولین کمپلکس NADH منتقل میشوند. این مجموعه، با عنوان کمپلکس I، از فلاوین مونونوکلئوتید (FMN) و پروتئین حاوی آهن – گوگرد (Fe-S) تشکیل شده است. FMN از ویتامین B2 مشتق شده است و به آن ریبوفلاوین (Riboflavin) نیز گفته میشود. ریبوفلاوین یکی از چندین گروه پروستتیک یا فاکتورهای مشترک در زنجیره انتقال الکترون است. یک گروه پروستتیک یک مولکول غیرپروتئینی است که وجود آن برای فعالیت یک پروتئین ضروری محسوب میشود.
گروههای پروستتیک مولکولهای غیرپپتیدی آلی یا معدنی هستند که به پروتئین متصل شده و عملکرد آن را تسهیل میکنند. به عنوان مثال، گروههای پروستتیک میتوانند شامل کوآنزیمها باشند که به عنوان گروههای پروستتیک آنزیمها به شمار میآیند.
آنزیم موجود در کمپلکس یک، «NADH دهیدروژناز» (NADH dehydrogenase) نام دارد، این آنزیم، پروتئین بسیار بزرگی است و ۴۵ زنجیره اسید آمینه دارد. کمپلکس I میتواند چهار یون هیدروژن را از طریق ماتریکس به درون فضای بین غشایی پمپ کند و از این طریق است که شیب یون هیدروژن بین دو محفظه جدا شده توسط غشای داخلی میتوکندری ایجاد میشود.
کمپلکس دو و یوبی کینون
کمپلکس II مستقیماً FADH2 را دریافت میکند، این حامل الکترونی نمیتواند از کمپلکس I عبور کند. ترکیبی که کمپلکسهای اول و دوم را به کمپلکس سوم متصل میکند، یوبی کینون (Ubiquinone Q) نام دارد. این مولکول که به کوآنزیم کیو (ْQ) نیز معروف است، محلول در چربی بوده و آزادانه از طریق هسته آبگریز غشا حرکت میکند.
پس از احیا این مولکول (QH2)، یوبی کینون الکترونهای خود را در زنجیره انتقال الکترون به کمپلکس بعدی منتقل میکند. یوبی کینون الکترونهای حاصل از NADH از کمپلکس I و الکترونهای مشتق شده از FADH2 از کمپلکس II را از طریق آنزیم «سوکسینات دهیدروژناز» (Succinate Dehydrogenase) دریافت میکند.
این آنزیم و FADH2 یک کمپلکس کوچک را تشکیل میدهند که الکترونها را به طور مستقیم به زنجیره انتقال الکترون منتقل میکند، از آنجایی که این الکترونها انرژی لازم برای پمپ پروتون را در اولین کمپلکس انرژی تامین نمیکنند، بنابراین مولکولهای ATP کمتری از الکترونهای FADH2 ساخته میشوند. تعداد مولکولهای ATP به دست آمده مستقیماً با تعداد پروتونهای پمپ شده در غشای داخلی میتوکندری متناسب است.
کمپلکس سوم
کمپلکس سوم متشکل از سیتوکروم b، پروتئین حاوی آهن – گوگرد (Fe-S) به نام مرکز Rieske (بخشی از سیتوکروم bc1) و پروتئین سیتوکروم c است. به کمپلکس سوم «سیتوکروم اکسیدوردوکتاز» (cytochrome oxidoreductase) نیز گفته میشود. پروتئینهای سیتوکروم دارای گروه پروستتیک متشکل از «هِم» (Heme) هستند. این مولکول هِم شبیه به هِم موجود در هموگلوبین است، اما در اینجا برخلاف هموگلوبین که اکسیژن را در رگهای خونی انتقال میدهد، الکترون را حمل میکند.
در نتیجه، با عبور الکترونها، یون آهن در هسته خود احیا و اکسیده میشود و در بین حالتهای مختلف اکسیداسیون نوسان میکند: ++Fe (کاهش یافته) و +++Fe (اکسید شده). مولکولهای هِم موجود در سیتوکرومها به دلیل تأثیر پروتئینهای مختلف که آنها را به هم متصل میکنند، دارای ویژگیهای کمی متفاوت هستند و به هر یک از مجموعهها ویژگیهای کمی متفاوت میدهند.
کمپلکس III پروتونها را از طریق غشا پمپ میکند و الکترونهای خود را به سیتوکروم c منتقل میکند تا به پروتئینها و آنزیمهای کمپلکس چهارم منتقل شوند (سیتوکروم c پذیرنده الکترونها از یوبی کینون است، با این حال، یوبی کینون معمولا یک جفت الکترون با خود حمل میکند، اما سیتوکروم c در یک زمان تنها میتواند یک الکترون را دریافت کند).
کمپلکس چهارم و پنجم
کمپلکس چهارم از پروتئینهای سیتوکروم c ،a و a3 تشکیل شده است. این مجموعه شامل دو گروه هِم (در هر یک از دو سیتوکروم a و a3 یک گروه هِم وجود دارد) و سه یون مس (یک جفت CuA و یک CuB در سیتوکروم a3) است. سیتوکرومها یک مولکول اکسیژن را به صورت کاملا پایدار بین یونهای آهن و مس نگه میدارند تا اینکه اکسیژن کاملاً احیا شود.
پس از احیا اکسیژن، دو یون هیدروژن از محیط اطراف در کنار آن قرار میگیرند تا یک مولکول آب (H2O) ایجاد شود. حذف یونهای هیدروژن از سیستم به شیب یون مورد استفاده در فرایند اسمز شیمیایی منجر میشود. در اسمز شیمیایی یا کمو اسمز (Chemiosmosis)، انرژی آزاد شده حاصل از سری واکنشهای اکسیداسیون و احیا که در بالا توضیح داده شدند، برای پمپ یونهای هیدروژن (پروتونها) از طول غشا استفاده میشود.
توزیع نامساوی یونهای هیدروژن در سراسر غشا، غلظت و شیبهای الکتریکی را ایجاد میکند (بنابراین یک گرادیان الکتروشیمیایی به وجود میآید)، این گرادیان به دلیل بار مثبت یونهای هیدروژن و تجمع آنها در یک طرف غشا ایجاد میشود.
اگر غشا برای انتشار یونهای هیدروژن باز باشد، یونها تمایل دارند که به داخل ماتریکس پخش شوند زیرا شیب الکتروشیمیایی آنها را این گونه هدایت میکند. باید این نکته را مد نظر قرار داد که بسیاری از یونها بدون کمک کانالهای یونی نمیتوانند در مناطق غیرقطبی غشاهای فسفولیپیدی پخش شوند.
به همین ترتیب، یونهای هیدروژن موجود در فضای ماتریکس فقط میتوانند از طریق غشای میتوکندری داخلی و به وسیله یک پروتئین غشایی انتگرال به نام «ATP سنتاز» (ATP Synthase) یا همان کمپلکس پنجم عبور کنند. این پروتئین پیچیده به عنوان یک ژنراتور کوچک عمل میکند و با نیروی یونهای هیدروژن که از طریق آن انتشار مییابند، فعال شده و گرادیان الکتروشیمیایی آنها را کاهش میدهد.
چرخش قسمتهایی از این دستگاه مولکولی اضافه کردن یک فسفات به ADP را برای ایجاد ATP تسهیل میکند، ATP سنتاز این کار را با استفاده از انرژی بالقوه شیب یون هیدروژن انجام میدهد. اسمز شیمیایی برای تولید ۹۰ درصد ATP ساخته شده در هنگام کاتابولیسم گلوکز هوازی استفاده میشود.







دیدگاه خود را ثبت کنید
تمایل دارید در گفتگو شرکت کنید؟نظری بدهید!